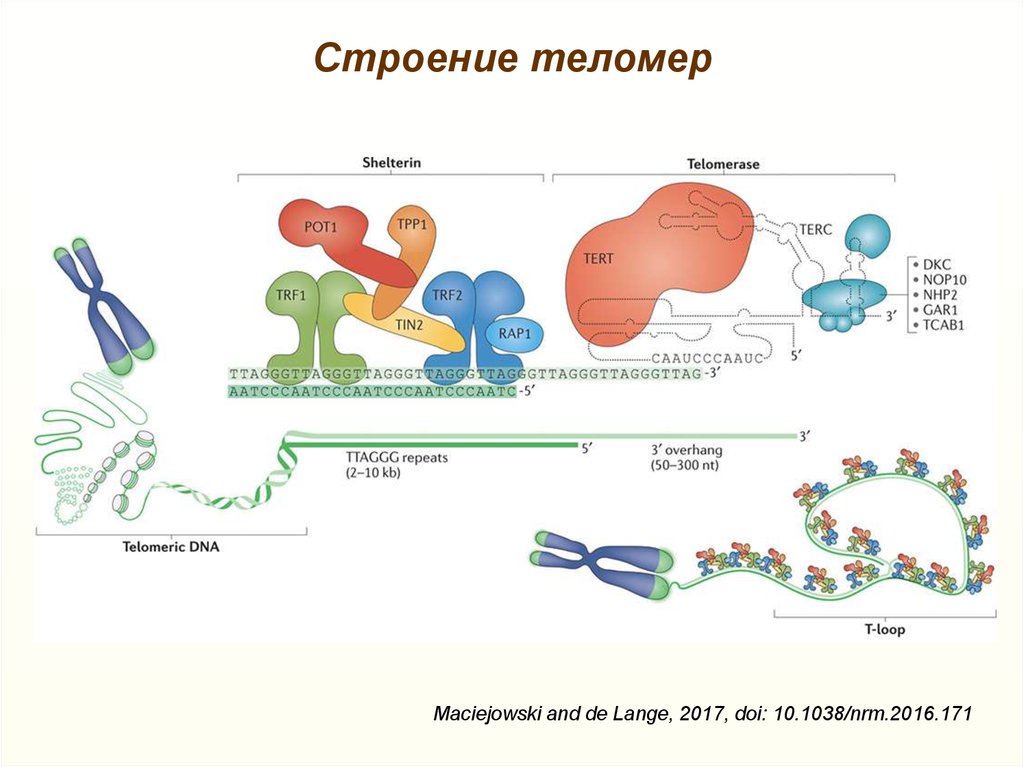
Теломеры | это… Что такое Теломеры?
Окрашенные хромосомы человека (синие) и их теломеры (белые)
Схема расположения теломер на хромосоме
Теломе́ры (от др.-греч. τέλος — конец и μέρος — часть) — концевые участки хромосом. Теломерные участки хромосом характеризуются отсутствием способности к соединению с другими хромосомами или их фрагментами и выполняют защитную функцию.
Термин «теломера» предложил Г. Мёллер в 1932 г[1].
У большинства эукариот теломеры состоят из специализированной линейной хромосомной ДНК, состоящей из коротких тандемных повторов. В теломерных участках хромосом ДНК вместе со специфически связывающимися с теломерными ДНК-повторами белками образует нуклеопротеидный комплекс — конститутивный (структурный) теломерный гетерохроматин. Теломерные повторы — весьма консервативные последовательности, например повторы всех позвоночных состоят из шести нуклеотидов TTAGGG, повторы всех насекомых — TTAGG, повторы большинства растений — TTTAGGG.
Ученые из университета Кардиффа (Cardiff University) установили, что критическая длина человеческой теломеры, при которой хромосомы начинают соединяться друг с другом, составляет 12,8 теломерных повторов[2].
В каждом цикле деления теломеры клетки укорачиваются из-за неспособности ДНК-полимеразы синтезировать копию ДНК с самого конца. Она в состоянии лишь добавлять нуклеотиды к уже существующей 3’-гидроксильной группе. По этой причине ДНК-полимераза нуждается в праймере, к которому она могла бы добавить первый нуклеотид. Данный феномен носит название концевой недорепликации и является одним из важнейших факторов биологического старения. Тем не менее, вследствие этого явления теломеры должны укорачиваться весьма медленно — по несколько (3–6) нуклеотидов за клеточный цикл, т.е. за количество делений, соответствующее пределу Хейфлика, они укоротятся всего на 150–300 нуклеотидов. В настоящее время предложена эпигенетическая теория старения, которая предполагает, что эрозия теломер ускоряется в десятки и сотни раз из-за рекомбинаций в их ДНК, вызванных функционированием клеточных систем репарации ДНК. Активность данных систем инициируется повреждением ДНК, обусловленном прежде всего дерепрессирующимися с возрастом мобильными элементами генома, что и предопределяет старение как биологический феномен[3].
Активность данных систем инициируется повреждением ДНК, обусловленном прежде всего дерепрессирующимися с возрастом мобильными элементами генома, что и предопределяет старение как биологический феномен[3].
Существует специальный фермент — теломераза, который при помощи собственной РНК-матрицы достраивает теломерные повторы и удлиняет теломеры. В большинстве дифференцированных клеток теломераза заблокирована, однако активна в стволовых и половых клетках.
За открытие защитных механизмов хромосом от концевой недорепликации с помощью теломер и теломеразы в 2009 году присуждена Нобелевская премия по физиологии и медицине австралийке, работающей в США, Элизабет Блекберн (Elizabeth Blackburn), американке Кэрол Грейдер (Carol Greider) и её соотечественнику Джеку Шостаку (Jack Szostack).
Примечания
- ↑ Muller H.J. Further studies on the nature and causes of gene mutations // Proc. Sixth Int. Congr. Genet. 1932. V.1. P.213-255.
- ↑ The nature of telomere fusion and a definition of the critical telomere length in human cells.

- ↑ Галицкий В.А. (2009). «Эпигенетическая природа старения» (русский). Цитология 51: 388–397.
См. также
- Центромера
Ссылки
- Скорость старения можно определить по числу родинок (благодаря теломерам)
- Теломера в БСЭ
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
Оценка изменения длины теломер хромосом как критерий продолжительности жизни в бариатрической практике | Бекмурзинова
Фарида Кайратовна Бекмурзинова,
Орал Базарбаевич Оспанов,
Айнур Рахметуловна Акильжанова,
Улан Анетович Кожамкулов,
Сауле Есламовна Рахимова
https://doi. org/10.14341/omet10331
org/10.14341/omet10331
Полный текст:
PDF (Rus)
|
HTML
|
XML
- Статья
- Об авторах
- Дополнительные файлы
Аннотация
В последние десятилетия неуклонно растет распространенность ожирения в большинстве стран мира. Избыточная масса тела является фактором риска широкого спектра эндокринных, сердечно-сосудистых, желудочно-кишечных, метаболических, неопластических и мышечно-скелетных нарушений и заболеваний. Как известно, ожирение – это состояние хронического воспаления и сильного окислительного стресса, что непременно оказывает влияние на длину теломер хромосом. Динамика изменений длины теломер играет решающую роль в регуляции клеточных процессов и клеточных изменений. Повреждение теломер, структур хроматина, помогающих поддерживать стабильность генома, приводит к гибели клеток или к их старению. Однако сведения о том, как изменяется длина теломер после снижения массы тела посредством бариатрических операций, остаются до настоящего времени ограниченными. Существует несколько видов бариатрических операций, каждый из которых имеет свои преимущества и недостатки. Исходя из этого, возможно, восстановление длины теломер будет отличаться в зависимости от использованной методики. В данном обзоре литературы описываются механизмы укорочения длины теломер лейкоцитов и то, как на это могут повлиять бариатрические операции. Обзор также включает в себя анализ доказательств, связывающих ожирение и ускоренные процессы старения, поскольку они регулируются теломерами.
Динамика изменений длины теломер играет решающую роль в регуляции клеточных процессов и клеточных изменений. Повреждение теломер, структур хроматина, помогающих поддерживать стабильность генома, приводит к гибели клеток или к их старению. Однако сведения о том, как изменяется длина теломер после снижения массы тела посредством бариатрических операций, остаются до настоящего времени ограниченными. Существует несколько видов бариатрических операций, каждый из которых имеет свои преимущества и недостатки. Исходя из этого, возможно, восстановление длины теломер будет отличаться в зависимости от использованной методики. В данном обзоре литературы описываются механизмы укорочения длины теломер лейкоцитов и то, как на это могут повлиять бариатрические операции. Обзор также включает в себя анализ доказательств, связывающих ожирение и ускоренные процессы старения, поскольку они регулируются теломерами.
Ключевые слова
длина теломер,
старение,
бариатрическая хирургия,
ожирение,
метаболический синдром
Для цитирования:
Бекмурзинова Ф. К., Оспанов О.Б., Акильжанова А.Р., Кожамкулов У.А., Рахимова С.Е. Оценка изменения длины теломер хромосом как критерий продолжительности жизни в бариатрической практике. Ожирение и метаболизм. 2020;17(2):125-129. https://doi.org/10.14341/omet10331
К., Оспанов О.Б., Акильжанова А.Р., Кожамкулов У.А., Рахимова С.Е. Оценка изменения длины теломер хромосом как критерий продолжительности жизни в бариатрической практике. Ожирение и метаболизм. 2020;17(2):125-129. https://doi.org/10.14341/omet10331
For citation:
Bekmurzinova F.K., Ospanov O.B., Akilzhanova A.R., Kozhamkulov U.A., Rakhimova S.E. The evaluation of chromosome telomere length change as a criterion of life expectancy in bariatric practice. Obesity and metabolism. 2020;17(2):125-129.
(In Russ.)
https://doi.org/10.14341/omet10331
ВВЕДЕНИЕ
Вопрос о продолжительности жизни пациентов с метаболическим синдромом в последние десятилетия является весьма актуальным, поскольку один из главных компонентов данного синдрома, ожирение, значится в списке главных причин преждевременной смертности населения. По данным Всемирной организации здравоохранения (ВОЗ), опубликованным в 2016 г., более 1,9 млрд взрослых старше 18 лет имели избыточный вес. Из них свыше 650 млн страдали ожирением. Ежегодно в мире от коморбидных ожирению заболеваний умирают около 2,8 млн человек. Темпы увеличения числа больных, страдающих ожирением, настолько велики, что данное заболевание приобретает характер неинфекционной эпидемии. Ожирение является условием, при котором происходит чрезмерное накопление жировой ткани, что может оказывать неблагоприятное воздействие на здоровье и приводить к уменьшению ожидаемой продолжительности жизни.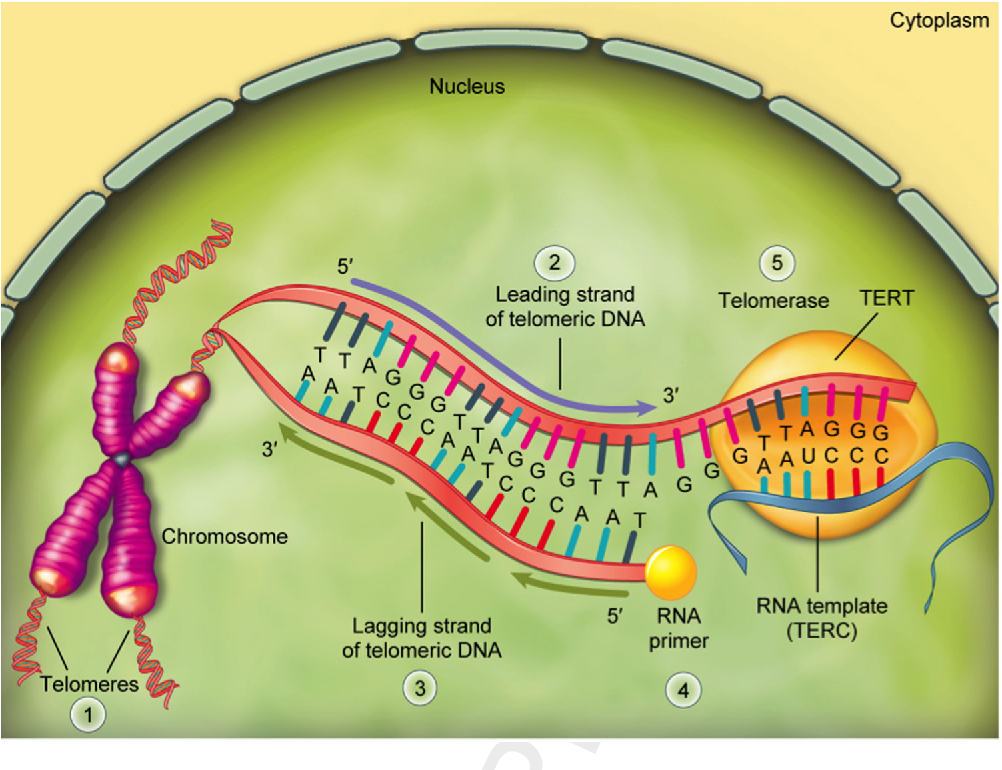 В соответствии с данными ВОЗ, ожирением обусловлено 44% случаев развития сахарного диабета 2 типа (СД2), 23% ишемической болезни сердца (ИБС) и 7–41% определенных видов рака [1]. Эти расстройства рассматриваются как следствие повышенного окислительного стресса и воспаления в организме.
В соответствии с данными ВОЗ, ожирением обусловлено 44% случаев развития сахарного диабета 2 типа (СД2), 23% ишемической болезни сердца (ИБС) и 7–41% определенных видов рака [1]. Эти расстройства рассматриваются как следствие повышенного окислительного стресса и воспаления в организме.
Увеличение окислительного стресса и воспаления влияет на длину теломер и может ускорить старение, поэтому теломеры являются ключевыми маркерами биологического старения [2]. Они представляют собой специализированные ДНК-белковые структуры, обнаруженные на концах эукариотических хромосом. Длина теломер играет важную роль в регуляции клеточных процессов и клеточной гибели, по состоянию теломер определяют не только продолжительность жизни одной клетки, но и состояние органов, систем и организма в целом.
Целью данного обзора литературы является критическая оценка и обобщение научных знаний о том, как изменяется продолжительность жизни пациентов с метаболическим синдромом после снижения массы тела.
При подготовке литературного обзора нами проведен анализ публикаций за последние 10 лет. Для поиска источников использовали базу данных PubMed, а также сайты издательств Springer и Elsiver для доступа к полнотекстовым версиям статей. Поиск публикаций осуществляли по соответствующим ключевым словам. Для PubMed: telomere length; aging; bariatric surgery; obesity; metabolic syndrome.
ГОМЕОСТАЗ ДЛИНЫ ТЕЛОМЕР
Теломеры представляют собой структуры ДНК, состоящие из тандемных повторов последовательности TTAGGG и ассоциированных белков на концах хромосом человека. ДНК теломер поддерживается высокорегулируемым действием клеточного фермента теломеразы. Посредством этого механизма хромосомная ДНК и гены защищены от повреждений во время процесса деления клетки [3]. Фермент теломераза – это специфический рибонуклеопротеин клетки, который в конечном счете работает как обратная транскриптаза и принимает участие в синтезе активных центров для связывания теломерной ДНК с теломерными защитными белками.
Удлинение теломер происходит в эмбриональном периоде, когда активен фермент теломераза и далее остается активным постнатально в клетках зародышевого пути и в некоторых стволовых клетках [4]. Этот процесс может быть активирован в тканях, которые требуют дальнейшего расширения количества клеток, например, в гемопоэтической системе [4]. В исследовании Gadalla et al. [5] наблюдается увеличение выживаемости реципиентов с трансплантацией костного мозга по поводу лечения апластической анемии, когда донорские ткани обладали более длинными теломерами. Это увеличение выживаемости связано с усилением теломерной способности, которая помогла восстановить гемопоэтическую систему.
Как известно, в S-фазу клеточного цикла происходит репликация ДНК, в результате чего каждый раз происходит недорепликация короткого концевого участка хроматиды. Для того чтобы каждый период репликации не сопровождался потерей значимых последовательностей ДНК, на концах хромосом возникли незначимые последовательности ДНК – теломеры [6]. Укорочение теломер – это механизм, который происходит вследствие нормального деления клеток и репликационного механизма. Данный механизм демонстрируется на опухолевых клетках [7], которые были модифицированы – имели длинные теломеры и высокую активность теломеразы; в лейкоцитах, которые были стимулированы митогеном [8], и в стволовых клетках человека [9]. Таким образом, в норме фермент теломераза активен только в эмбриональном периоде, далее в постэмбриональном периоде происходит только сокращение длины теломер в процессе репликации.
Укорочение теломер – это механизм, который происходит вследствие нормального деления клеток и репликационного механизма. Данный механизм демонстрируется на опухолевых клетках [7], которые были модифицированы – имели длинные теломеры и высокую активность теломеразы; в лейкоцитах, которые были стимулированы митогеном [8], и в стволовых клетках человека [9]. Таким образом, в норме фермент теломераза активен только в эмбриональном периоде, далее в постэмбриональном периоде происходит только сокращение длины теломер в процессе репликации.
МЕХАНИЗМЫ УКОРОЧЕНИЯ ТЕЛОМЕР
Теломерная ДНК чувствительна к естественной терминальной эрозии за счет различных процессов, включая механизм репликации линейной хромосомной ДНК, которая приводит к уменьшению длины теломер с каждым делением клеток [10], а также процессов, связанных с действием нуклеазы, репликации, рекомбинации ДНК и действием окислительного стресса. Несмотря на то что фермент теломераза способен противодействовать укорочению длины теломер, активность его обычно отсутствует в нормальных клетках взрослого человека. Когда длина теломер уменьшается до критического значения, это приводит к репликативному старению и гибели клеток [11, 12]. Генетическая предрасположенность к более длинным теломерам связана с повышенным риском развития рака [13–15].
Когда длина теломер уменьшается до критического значения, это приводит к репликативному старению и гибели клеток [11, 12]. Генетическая предрасположенность к более длинным теломерам связана с повышенным риском развития рака [13–15].
В нескольких независимых исследованиях было показано, что уменьшение длины теломерной ДНК человека связано с широким спектром различных заболеваний и для нескольких возрастных групп больных, где можно прогнозировать будущие риски и исходы, включая смертность.
У пожилых людей происходит укорочение теломер во всех клетках крови, но скорость укорочения у всех разная. Изменение длины теломер с возрастом – нестабильный процесс, так, например, наиболее резкое уменьшение длины в лимфоцитах происходит в течение первого года жизни, затем этот процесс замедляется и приблизительно после 30 лет имеет постоянный уровень [16].
При некоторых генетических заболеваниях человека, таких как синдром Дауна, синдром Ди Джорджи, а также при врожденном дискератозе происходит раннее сокращение длины теломер, и это обусловлено несколькими мутациями в гене субъединицы hTERT теломеразы, которая стабилизирует длину теломер [17, 18].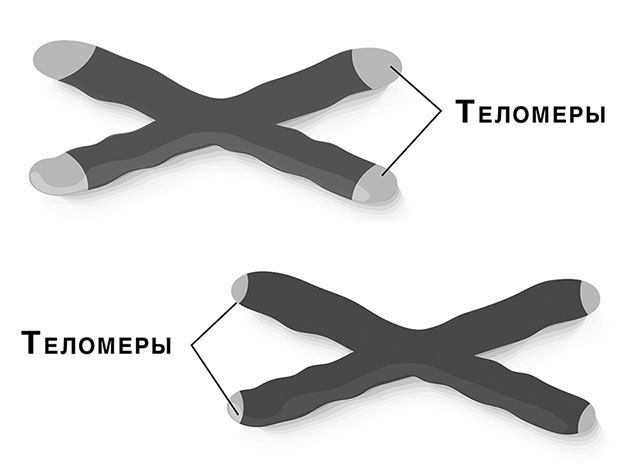
Имеются данные, где показана роль воздействия стресса и его влияние на быстрое укорочение теломер в клетках, и этот эффект зависел от продолжительности и интенсивности воздействия стресса [19]. Повреждается хромосома, ДНК теломеры, а также уменьшается длина теломеры при оксидативном стрессе, независимо от причин, вызвавших стресс. Стаж курения напрямую влияет на степень укорочения теломер, так, чем стаж курения больше, тем сильнее происходит сокращение длины теломер в лимфоцитах [20].
Можно сказать, что изменение длины теломер связано с развитием сердечно-сосудистых (ССЗ) и инфекционных заболеваний [21, 22]. Риск смертности от ССЗ у больных с более короткими теломерами в лейкоцитах крови увеличен в 3 раза, а от инфекционных – в 8 раз [23–25]. Такие же риски смертности отмечены при сахарном диабете 2 типа, что также связано с окислительным стрессом, который, в свою очередь, влияет на длину теломер клеток крови [26].
Бесспорно, ожирение влияет на длину теломер и может ускорить процесс старения. Имеется четкая связь между индексом массы тела (ИМТ) и длиной теломер лейкоцитов, которая варьируется в зависимости от возраста. Ожирение рассматривается как основной детерминант в регуляции старения жировой ткани наряду с метаболическими изменениями, такими как повышение провоспалительных цитокинов, развитие инсулинорезистентности, сахарный диабет 2 типа и ССЗ. По результатам исследования [27] становится ясно, что ИМТ имеет значительную корреляцию с длиной теломер у пациентов моложе 60 лет.
Имеется четкая связь между индексом массы тела (ИМТ) и длиной теломер лейкоцитов, которая варьируется в зависимости от возраста. Ожирение рассматривается как основной детерминант в регуляции старения жировой ткани наряду с метаболическими изменениями, такими как повышение провоспалительных цитокинов, развитие инсулинорезистентности, сахарный диабет 2 типа и ССЗ. По результатам исследования [27] становится ясно, что ИМТ имеет значительную корреляцию с длиной теломер у пациентов моложе 60 лет.
ОПЕРАТИВНОЕ ЛЕЧЕНИЕ ОЖИРЕНИЯ И ДЛИНА ТЕЛОМЕР
Распространенность ожирения связана с возрастающей урбанизацией, снижением физической активности и легкой доступностью высококалорийных продуктов. В связи с этим возникает необходимость поиска эффективных способов снижения массы тела.
Традиционно основным методом лечения ожирения был консервативный, однако данный вид терапии носит непродолжительный характер и малоэффективен. С середины XX в. стали разрабатываться хирургические методы коррекции избыточной массы тела.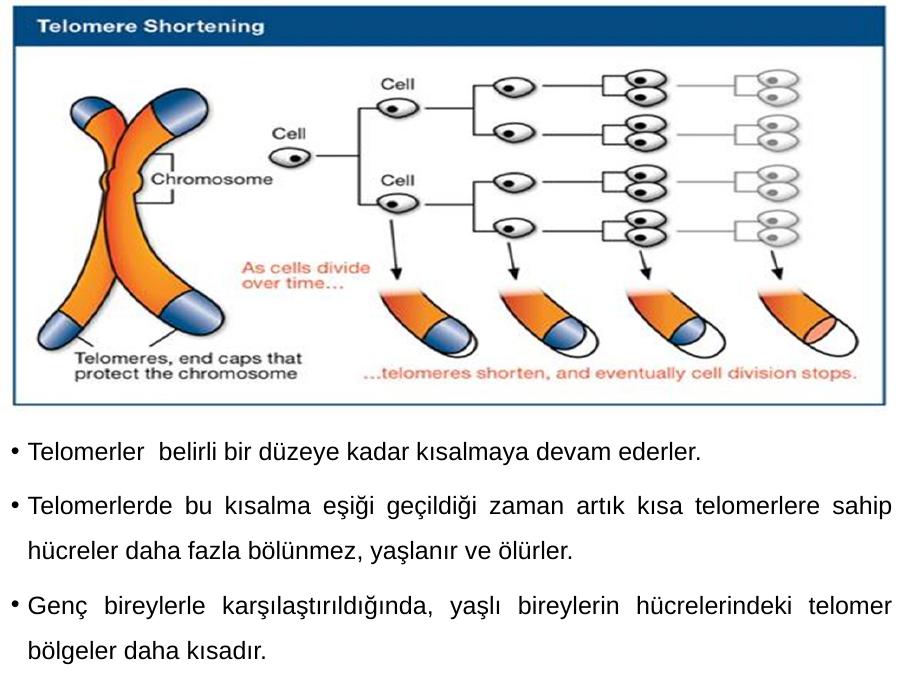 Бариатрическая хирургия сформировалась как отдельная область знаний. Хирургия ожирения широко признана и является наиболее эффективным видом лечения. Это единственный известный метод, который приводит к значительной потере веса и предотвращает его восстановление. В мировой практике используют десятки различных бариатрических операций. Ежегодно проводится более 500 000 хирургических вмешательств по поводу снижения избыточной массы тела. Их них продольная резекция желудка составляет 49%, гастрошунтирование по Ру – 43% всех выполняемых бариатрических операций [28–30].
Бариатрическая хирургия сформировалась как отдельная область знаний. Хирургия ожирения широко признана и является наиболее эффективным видом лечения. Это единственный известный метод, который приводит к значительной потере веса и предотвращает его восстановление. В мировой практике используют десятки различных бариатрических операций. Ежегодно проводится более 500 000 хирургических вмешательств по поводу снижения избыточной массы тела. Их них продольная резекция желудка составляет 49%, гастрошунтирование по Ру – 43% всех выполняемых бариатрических операций [28–30].
Основываясь на исследовании [31], авторы утверждают, что после операции гастрошунтирования по Ру пациенты показали значительное снижение ИМТ, и наблюдалось увеличение длины теломер, а также снижение в них окислительного стресса. Следовательно, данная методика операции улучшает фенотип преждевременного старения.
Caetano de Queiroz и соавт. [32] провели исследование, основанное на наблюдении за 120 пациентами через 2 года после гастрошунтирования по Ру, по результатам которого были доказаны эффективность и безопасность операции в борьбе с ожирением и связанными с ним состояниями.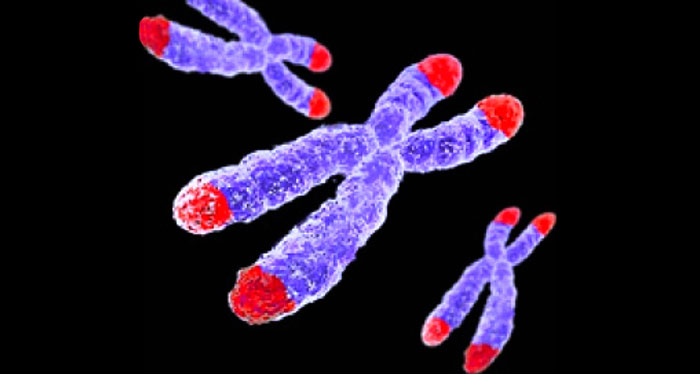 Смертность была равна нулю. Среднее значение потери лишнего веса EWL (Exсess Weight Loss) составило 75%. При этом в 4,2% случаях имелись осложнения.
Смертность была равна нулю. Среднее значение потери лишнего веса EWL (Exсess Weight Loss) составило 75%. При этом в 4,2% случаях имелись осложнения.
ОБСУЖДЕНИЕ
После хирургического лечения ожирения пациенты резко теряют массу тела в основном в первые 1–2 года [33]. В результате чего происходит снижение уровня провоспалительных цитокинов [34], что влияет в той или иной степени на длину теломер. В исследовании Formichi et al. выявили уменьшение длины через 1 год после хирургического лечения ожирения [35]. Однако Laimer et al., наоборот, отмечали увеличение длины теломер в течение 10 лет после бариатрической операции [36]. Также удлинение длины теломер через 3–5 лет после операции наблюдали другие авторы [37]. Следовательно, нами в результате анализа литературы были получены противоречивые данные по изменению длины теломер.
Вместе с тем важно отметить, что, по данным литературных источников, ключевой особенностью гастрошунтирования является то, что эта операция позволяет пациентам поддерживать значительное снижение массы тела в долгосрочной перспективе.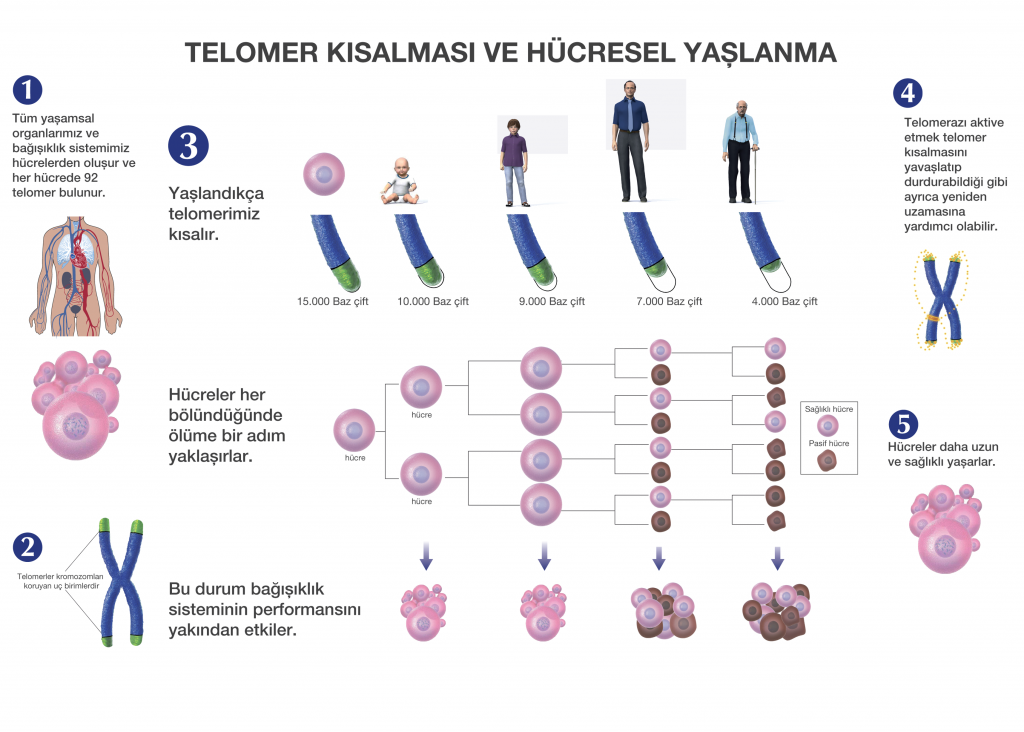 Однако эффекты бариатрической хирургии не ограничиваются только потерей веса, также отмечается улучшение функции жировой ткани и изменение чувствительности к инсулину [38]. По данным ряда авторов [31], выявляется значительное снижение провоспалительных маркеров, таких как интерлейкин-6 и C-реактивный белок у пациентов через 2 года после операции. Это способствует уменьшению окислительного стресса, что предотвращает преждевременное старение и гибель клеток.
Однако эффекты бариатрической хирургии не ограничиваются только потерей веса, также отмечается улучшение функции жировой ткани и изменение чувствительности к инсулину [38]. По данным ряда авторов [31], выявляется значительное снижение провоспалительных маркеров, таких как интерлейкин-6 и C-реактивный белок у пациентов через 2 года после операции. Это способствует уменьшению окислительного стресса, что предотвращает преждевременное старение и гибель клеток.
Насколько нам известно, в данный момент в мире нет исследований по изучению изменению длины теломер лейкоцитов после бесстеплерных типов гастрошунтирования, которые могут быть наиболее доступными и вместе с тем не менее эффективными, чем бариатрические и метаболические операции по степлерной технологии [39–40]. Но вместе с тем известно, что такие исследования планируется провести в ближайшие годы [41].
Таким образом, результаты представленного литературного обзора указывают на то, что в настоящее время в мире отмечается глобальная тенденция к росту ожирения, ведется множество исследований по лечению и профилактике осложнений данной патологии.
Проанализировав результаты вышеуказанных исследований, стоит сказать о том, что в настоящий момент имеется недостаточное количество знаний в этой области. В доступной литературе было найдено всего 5 публикаций о том, как изменяется длина теломер лейкоцитов, а следовательно, продолжительность жизни после снижения массы тела посредством бариатрических операций, по итогам которых были получены противоречивые данные. Одни авторы утверждают, что длина теломер не увеличивается, а наоборот, уменьшается вследствие катаболического состояния после снижения массы тела [35]. А немало других авторов, которые считают, что происходит значительное восстановление длины теломер, которое связано с уменьшением окислительного процесса в клетках после бариатрической хирургии [31, 36, 37].
Следовательно, данный аспект диктует необходимость продолжения исследования в этом направлении с целью выявления изменения длины хромосомных теломер при ожирении в зависимости от степени снижении массы тела.
ЗАКЛЮЧЕНИЕ
В ходе обзора литературы была выявлена патогенетическая значимость длины теломер лейкоцитов в продолжительности жизни пациентов с метаболическим синдромом после бариатрических операций. Также было установлено, что после значительного снижения массы тела наблюдается чаще всего удлинение теломер лейкоцитов. Однако требуются дополнительные исследования, которые могли бы установить влияние снижения массы тела при ожирении на продолжительность жизни и, возможно, раскрыть важные механизмы, лежащие в основе долголетия.
Также было установлено, что после значительного снижения массы тела наблюдается чаще всего удлинение теломер лейкоцитов. Однако требуются дополнительные исследования, которые могли бы установить влияние снижения массы тела при ожирении на продолжительность жизни и, возможно, раскрыть важные механизмы, лежащие в основе долголетия.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Подготовка и публикация рукописи проведены на личные средства авторского коллектива.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Бекмурзинова Ф.K. – сбор, обработка и анализ публикаций, написание основного текста статьи; Оспанов О.Б. – критический пересмотр содержания статьи, написание текста в разделе «Оперативное лечение ожирения и длина теломер», а также раздела «Обсуждение»; Акильжанова А.Р. – редактирование текста статьи в части вопросов, касающихся гомеостаза длины теломер; Кожамкулов У. А. – редактирование текста статьи в части механизмов укорочения длины теломер; Рахимова С.Е. – составление резюме публикации. Все авторы внесли значимый вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию статьи перед публикацией.
А. – редактирование текста статьи в части механизмов укорочения длины теломер; Рахимова С.Е. – составление резюме публикации. Все авторы внесли значимый вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию статьи перед публикацией.
Список литературы
1. Metabolic mediators of the effects of body-mass index, overweight, and obesity on coronary heart disease and stroke: a pooled analysis of 97 prospective cohorts with 1·8 million participants. Lancet. 2014;383(9921):970-983. DOI:10.1016/s0140-6736(13)61836-x
2. Tzanetakou IP, Katsilambros NL, Benetos A, et al. «Is obesity linked to aging?»: adipose tissue and the role of telomeres. Ageing Res Rev. 2012;11(2):220-229. DOI:10.1016/j.arr.2011.12.003
3. Paul L. Diet, nutrition and telomere length. J Nutr Biochem. 2011;22(10):895-901. DOI:10.1016/j.jnutbio.2010.12.001
4. Reddel RR. Telomere maintenance mechanisms in cancer: clinical implications. Curr Pharm Des. 2014;20(41):6361-6374.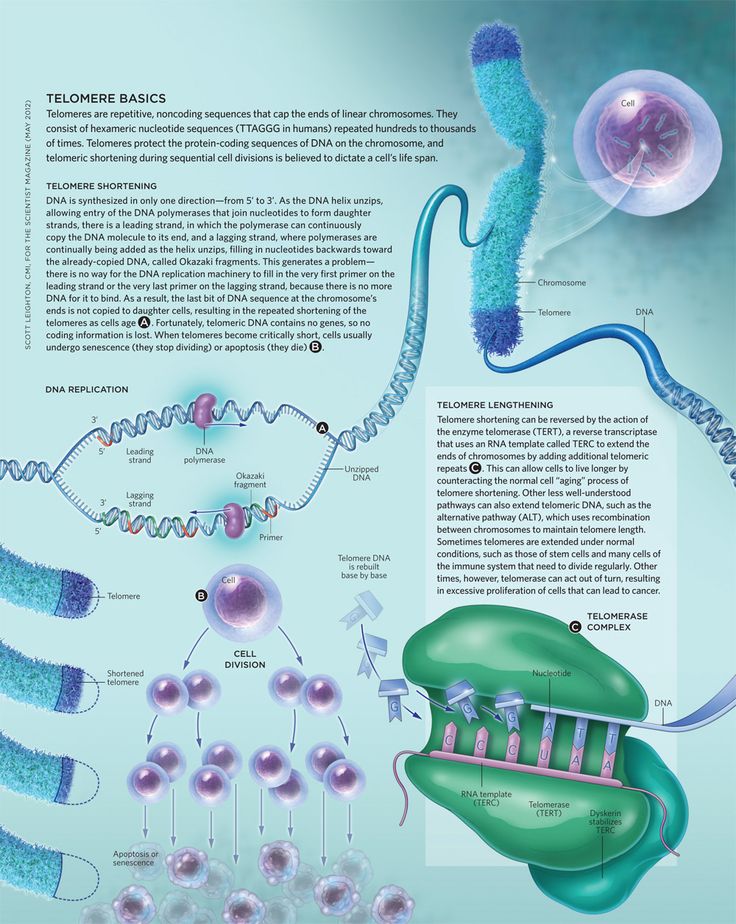 DOI:10.2174/1381612820666140630101047
DOI:10.2174/1381612820666140630101047
5. Gadalla SM, Wang T, Haagenson M, et al. Association between donor leukocyte telomere length and survival after unrelated allogeneic hematopoietic cell transplantation for severe aplastic anemia. JAMA. 2015;313(6):594-602. DOI:10.1001/jama.2015.7
6. Fasching CL. Telomere length measurement as a clinical biomarker of aging and disease. Crit Rev Clin Lab Sci. 2018;55(7):443-465. DOI:10.1080/10408363.2018.1504274
7. Pickett HA, Cesare AJ, Johnston RL, et al. Control of telomere length by a trimming mechanism that involves generation of t-circles. EMBO J. 2009;28(7):799-809. DOI:10.1038/emboj.2009.42
8. Pickett HA, Henson JD, Au AY, et al. Normal mammalian cells negatively regulate telomere length by telomere trimming. Hum Mol Genet. 2011;20(23):4684-4692. DOI:10.1093/hmg/ddr402
9. Rivera T, Haggblom C, Cosconati S, Karlseder J. A balance between elongation and trimming regulates telomere stability in stem cells. Nat Struct Mol Biol. 2017;24(1):30-39. DOI:10.1038/nsmb.3335
2017;24(1):30-39. DOI:10.1038/nsmb.3335
10. Blackburn EH. Telomeres and telomerase: their mechanisms of action and the effects of altering their functions. FEBS Lett. 2005;579(4):859-862. DOI:10.1016/j.febslet.2004.11.036
11. Lopez-Otin C, Blasco MA, Partridge L, et al. The hallmarks of aging. Cell. 2013;153(6):1194-1217. DOI:10.1016/j.cell.2013.05.039
12. Armanios M, Blackburn EH. The telomere syndromes. Nat Rev Genet. 2012;13(10):693-704. DOI:10.1038/nrg3246
13. Blackburn EH, Epel ES, Lin J. Human telomere biology: A contributory and interactive factor in aging, disease risks, and protection. Science. 2015;350(6265):1193-1198. DOI:10.1126/science.aab3389
14. Bojesen SE, Pooley KA, Johnatty SE, et al. Multiple independent variants at the TERT locus are associated with telomere length and risks of breast and ovarian cancer. Nat Genet. 2013;45(4):371-384, 384e371-372. DOI:10.1038/ng.2566
15. Walsh KM, Codd V, Smirnov IV, et al. Variants near TERT and TERC influencing telomere length are associated with high-grade glioma risk. Nat Genet. 2014;46(7):731-735. DOI:10.1038/ng.3004
Nat Genet. 2014;46(7):731-735. DOI:10.1038/ng.3004
16. Aviv A, Chen W, Gardner JP, et al. Leukocyte telomere dynamics: longitudinal findings among young adults in the Bogalusa Heart Study. Am J Epidemiol. 2009;169(3):323-329. DOI:10.1093/aje/kwn338
17. Nelson ND, Bertuch AA. Dyskeratosis congenita as a disorder of telomere maintenance. Mutat Res. 2012;730(1-2):43-51. DOI:10.1016/j.mrfmmm.2011.06.008
18. Albizua I, Rambo-Martin BL, Allen EG, et al. Association between telomere length and chromosome 21 nondisjunction in the oocyte. Hum Genet. 2015;134(11-12):1263-1270. DOI:10.1007/s00439-015-1603-0
19. Lin J, Epel E, Blackburn E. Telomeres and lifestyle factors: roles in cellular aging. Mutat Res. 2012;730(1-2):85-89. DOI:10.1016/j.mrfmmm.2011.08.003
20. Valdes AM, Andrew T, Gardner JP, et al. Obesity, cigarette smoking, and telomere length in women. Lancet. 2005;366(9486):662-664. DOI:10.1016/s0140-6736(05)66630-5
21. Raschenberger J, Kollerits B, Hammerer-Lercher A, et al.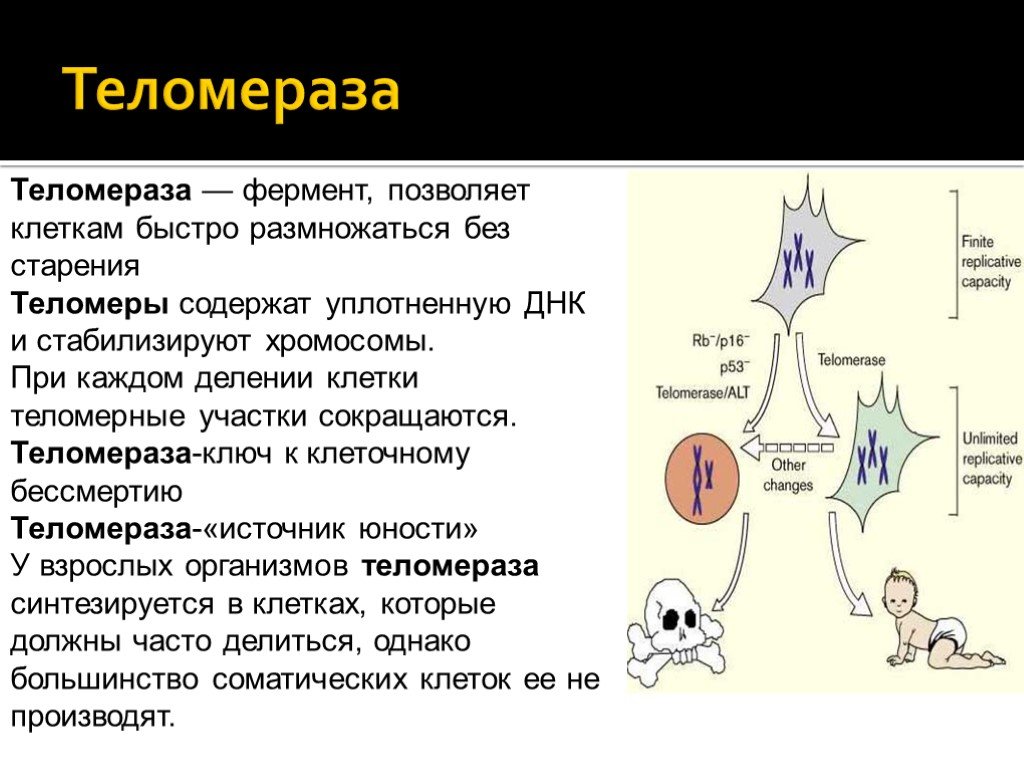 The association of relative telomere length with symptomatic peripheral arterial disease: results from the CAVASIC study. Atherosclerosis. 2013;229(2):469-474. DOI:10.1016/j.atherosclerosis.2013.05.027
The association of relative telomere length with symptomatic peripheral arterial disease: results from the CAVASIC study. Atherosclerosis. 2013;229(2):469-474. DOI:10.1016/j.atherosclerosis.2013.05.027
22. Mainous AG, 3rd, Codd V, Diaz VA, et al. Leukocyte telomere length and coronary artery calcification. Atherosclerosis. 2010;210(1):262-267. DOI:10.1016/j.atherosclerosis.2009.10.047
23. Cawthon RM, Smith KR, O’Brien E, et al. Association between telomere length in blood and mortality in people aged 60 years or older. Lancet. 2003;361(9355):393-395. DOI:10.1016/s0140-6736(03)12384-7
24. Zanet DL, Thorne A, Singer J, et al. Association Between Short Leukocyte Telomere Length and HIV Infection in a Cohort Study: No Evidence of a Relationship With Antiretroviral Therapy. Clin Infect Dis. 2014;58(9):1322-1332. DOI:10.1093/cid/ciu051
25. van de Berg PJ, Griffiths SJ, Yong SL, et al. Cytomegalovirus infection reduces telomere length of the circulating T cell pool. J Immunol.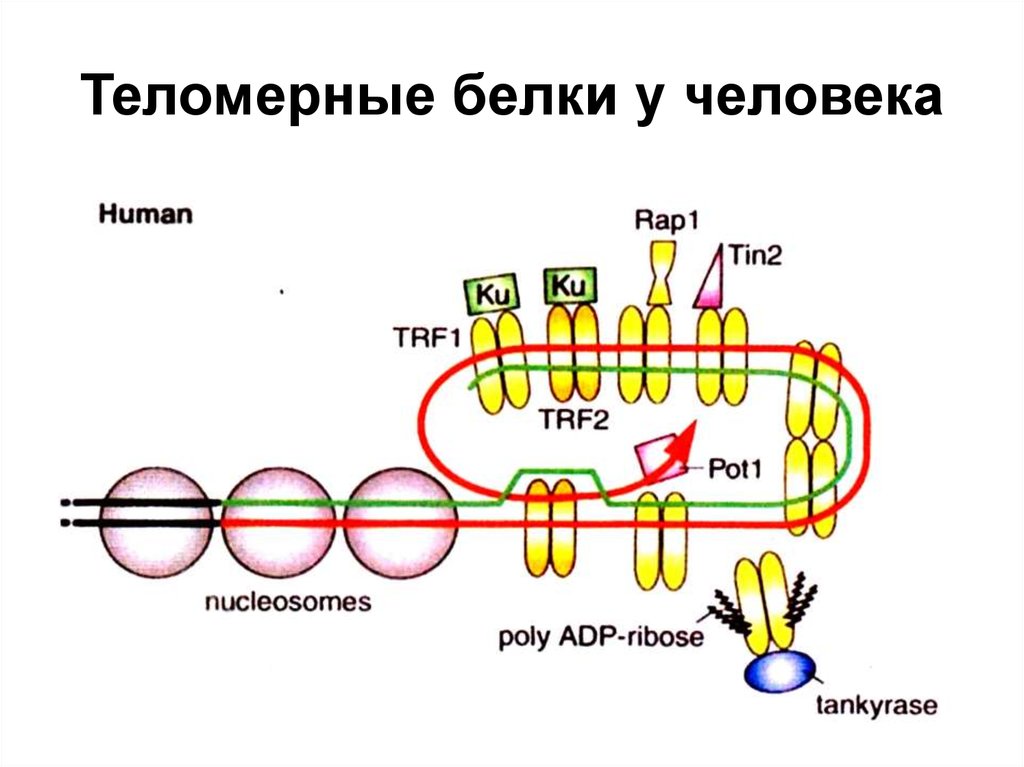 2010;184(7):3417-3423. DOI:10.4049/jimmunol.0903442
2010;184(7):3417-3423. DOI:10.4049/jimmunol.0903442
26. Willeit P, Raschenberger J, Heydon EE, et al. Leucocyte telomere length and risk of type 2 diabetes mellitus: new prospective cohort study and literature-based meta-analysis. PLoS One. 2014;9(11):e112483. DOI:10.1371/journal.pone.0112483
27. Muezzinler A, Mons U, Dieffenbach AK, et al. Body mass index and leukocyte telomere length dynamics among older adults: Results from the ESTHER cohort. Exp Gerontol. 2016;74:1-8. DOI:10.1016/j.exger.2015.11.019
28. Angrisani L, Santonicola A, Iovino P, et al. Bariatric Surgery Worldwide 2013. Obes Surg. 2015;25(10):1822-1832. DOI:10.1007/s11695-015-1657-z
29. Khorgami Z, Andalib A, Corcelles R, et al. Recent National Trends In The Surgical Treatment of Obesity: Sleeve Gastrectomy Dominates. Surg Obes Relat Dis. 2015;11(6):S6-S8. DOI:10.1016/j.soard.2015.10.012
30. Nicoletti C, Cortes-Oliveira C, Pinhel M, Nonino C. Bariatric Surgery and Precision Nutrition. Nutrients.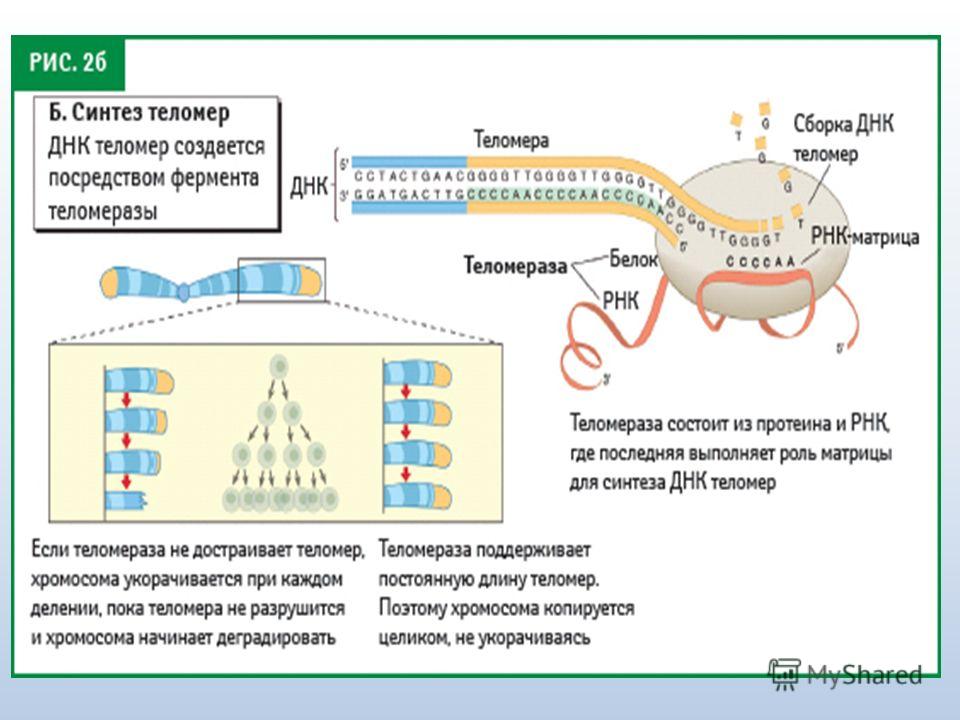 2017;9(9):974. DOI:10.3390/nu9090974
2017;9(9):974. DOI:10.3390/nu9090974
31. Hohensinner PJ, Kaun C, Ebenbauer B, et al. Reduction of Premature Aging Markers After Gastric Bypass Surgery in Morbidly Obese Patients. Obes Surg. 2018;28(9):2804-2810. DOI:10.1007/s11695-018-3247-3
32. Queiroz C, Sallet JA, PG DEBES, et al. Application of BAROS’ questionnaire in obese patients undergoing bariatric surgery with 2 years of evolution. Arq Gastroenterol. 2017;54(1):60-64. DOI:10.1590/S0004-2803.2017v54n1-12
33. Sjostrom L. Review of the key results from the Swedish Obese Subjects (SOS) trial — a prospective controlled intervention study of bariatric surgery. J Intern Med. 2013;273(3):219-234. DOI:10.1111/joim.12012
34. Barazzoni R, Palmisano S, Gortan Cappellari G, et al. Gastric bypass-induced weight loss alters obesity-associated patterns of plasma pentraxin-3 and systemic inflammatory markers. Surg Obes Relat Dis. 2016;12(1):23-32. DOI:10.1016/j.soard.2015.04.013
35. Formichi C, Cantara S, Ciuoli C, et al.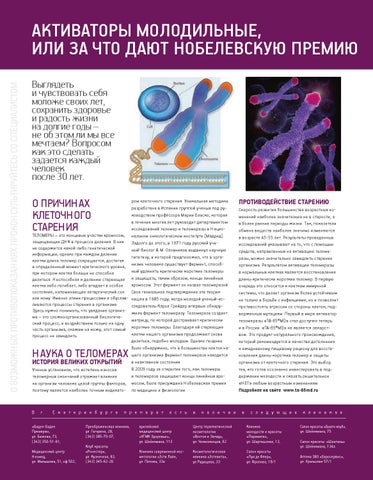 Weight loss associated with bariatric surgery does not restore short telomere length of severe obese patients after 1 year. Obes Surg. 2014;24(12):2089-2093. DOI:10.1007/s11695-014-1300-4
Weight loss associated with bariatric surgery does not restore short telomere length of severe obese patients after 1 year. Obes Surg. 2014;24(12):2089-2093. DOI:10.1007/s11695-014-1300-4
36. Laimer M, Melmer A, Lamina C, et al. Telomere length increase after weight loss induced by bariatric surgery: results from a 10 year prospective study. Int J Obes (Lond). 2016;40(5):773-778. DOI:10.1038/ijo.2015.238
37. Dershem R, Chu X, Wood GC, et al. Changes in telomere length 3-5 years after gastric bypass surgery. Int J Obes (Lond). 2017;41(11):1718-1720. DOI:10.1038/ijo.2017.156
38. Frikke-Schmidt H, O’Rourke RW, Lumeng CN, et al. Does bariatric surgery improve adipose tissue function? Obes Rev. 2016;17(9):795-809. DOI:10.1111/obr.12429
39. Ospanov O, Buchwald JN, Yeleuov G, Bekmurzinova F. Laparoscopic One-Anastomosis Gastric Bypass with Band-Separated Gastric Pouch (OAGB-BSGP): a Randomized Controlled Trial. Obes Surg. 2019;29(12):4131-4137. DOI:10.1007/s11695-019-04236-1
40. Ospanov OB. Surgical technique of laparoscopic mini-gastric bypass with obstructive stapleless pouch creation: A case series. Int J Surg. 2019;67:70-75. DOI:10.1016/j.ijsu.2019.05.011
Ospanov OB. Surgical technique of laparoscopic mini-gastric bypass with obstructive stapleless pouch creation: A case series. Int J Surg. 2019;67:70-75. DOI:10.1016/j.ijsu.2019.05.011
41. Ospanov O, Yeleuov G, Kadyrova I, Bekmurzinova F. The life expectancy of patients with metabolic syndrome after weight loss: study protocol for a randomized clinical trial (LIFEXPE-RT). Trials. 2019;20(1):202. DOI:10.1186/s13063-019-3304-9
Об авторах
Фарида Кайратовна Бекмурзинова
Омский государственный медицинский университет
Россия
клинический ординатор
Орал Базарбаевич Оспанов
Медицинский университет Астана; Лаборатория геномной и персонализированной медицины «Национальная Лаборатория Астана» Назарбаев Университета
Казахстан
Доктор медицинских наук, профессор, заведующий кафедрой лапароскопической и бариатрической хирургии
Айнур Рахметуловна Акильжанова
Лаборатория геномной и персонализированной медицины «Национальная Лаборатория Астана» Назарбаев Университета
Казахстан
д. м.н., профессор
м.н., профессор
Улан Анетович Кожамкулов
Лаборатория геномной и персонализированной медицины «Национальная Лаборатория Астана» Назарбаев Университета
Казахстан
Кандидат медицинских наук, ведущий научный сотрудник Лаборатории геномной и персонализированной медицины
Сауле Есламовна Рахимова
Лаборатория геномной и персонализированной медицины «Национальная Лаборатория Астана» Назарбаев Университета
Казахстан
Кандидат биологических наук, ведущий научный сотрудник Лаборатории геномной и персонализированной медицины
Дополнительные файлы
Рецензия
Для цитирования:
Бекмурзинова Ф.К., Оспанов О.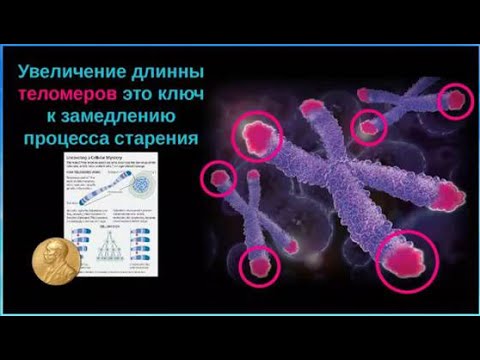 Б., Акильжанова А.Р., Кожамкулов У.А., Рахимова С.Е. Оценка изменения длины теломер хромосом как критерий продолжительности жизни в бариатрической практике. Ожирение и метаболизм. 2020;17(2):125-129. https://doi.org/10.14341/omet10331
Б., Акильжанова А.Р., Кожамкулов У.А., Рахимова С.Е. Оценка изменения длины теломер хромосом как критерий продолжительности жизни в бариатрической практике. Ожирение и метаболизм. 2020;17(2):125-129. https://doi.org/10.14341/omet10331
For citation:
Bekmurzinova F.K., Ospanov O.B., Akilzhanova A.R., Kozhamkulov U.A., Rakhimova S.E. The evaluation of chromosome telomere length change as a criterion of life expectancy in bariatric practice. Obesity and metabolism. 2020;17(2):125-129.
(In Russ.)
https://doi.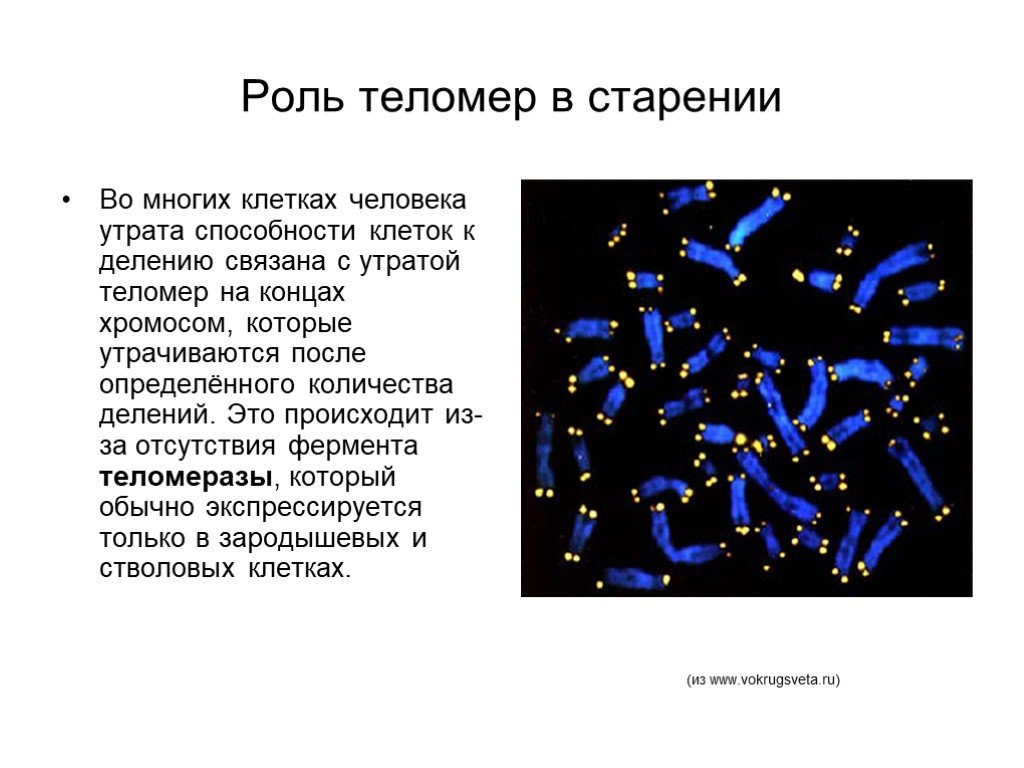 org/10.14341/omet10331
org/10.14341/omet10331
Просмотров: 2145
Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
Что такое теломера? – Ваш геном
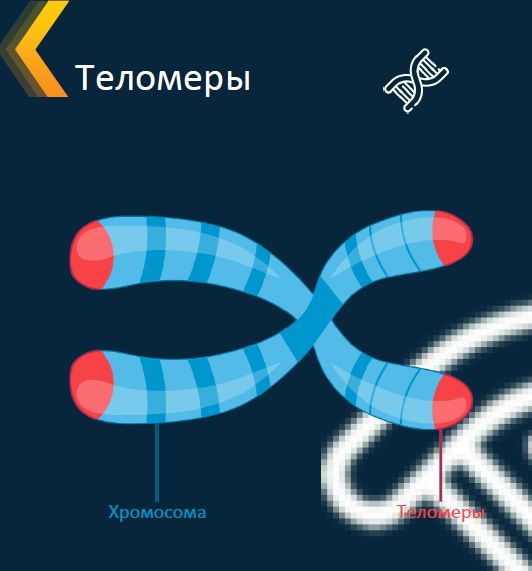
- Теломеры — это участки ДНК, находящиеся на концах каждой из наших хромосом.
- Они состоят из одной и той же последовательности оснований, повторяющихся снова и снова.
- У человека последовательность теломер — TTAGGG.
- Эта последовательность обычно повторяется около 3000 раз и может достигать в длину до 15000 пар оснований.
Иллюстрация, показывающая положение теломер на концах наших хромосом.
Изображение предоставлено: Genome Research Limited
Что делают теломеры?
Теломеры служат трем основным целям:
- Они помогают организовать каждую из наших 46 хромосом в ядре (центре управления) наших клеток.
- Они защищают концы наших хромосом, образуя колпачок, очень похожий на пластиковый наконечник на шнурках.
 Если бы теломер не было, наши хромосомы могли бы прилипнуть к другим хромосомам.
Если бы теломер не было, наши хромосомы могли бы прилипнуть к другим хромосомам. - Они позволяют хромосоме правильно реплицироваться во время клеточного деления:
- Каждый раз, когда клетка выполняет репликацию ДНК, хромосомы укорачиваются примерно на 25-200 оснований (A, C, G или T) за каждую репликацию.
- Однако, поскольку концы защищены теломерами, единственная часть хромосомы, которая теряется, — это теломеры, и ДНК остается неповрежденной.
- Без теломер важная часть ДНК терялась бы при каждом делении клетки (обычно от 50 до 70 раз).
- Это в конечном итоге привело бы к потере целых генов.
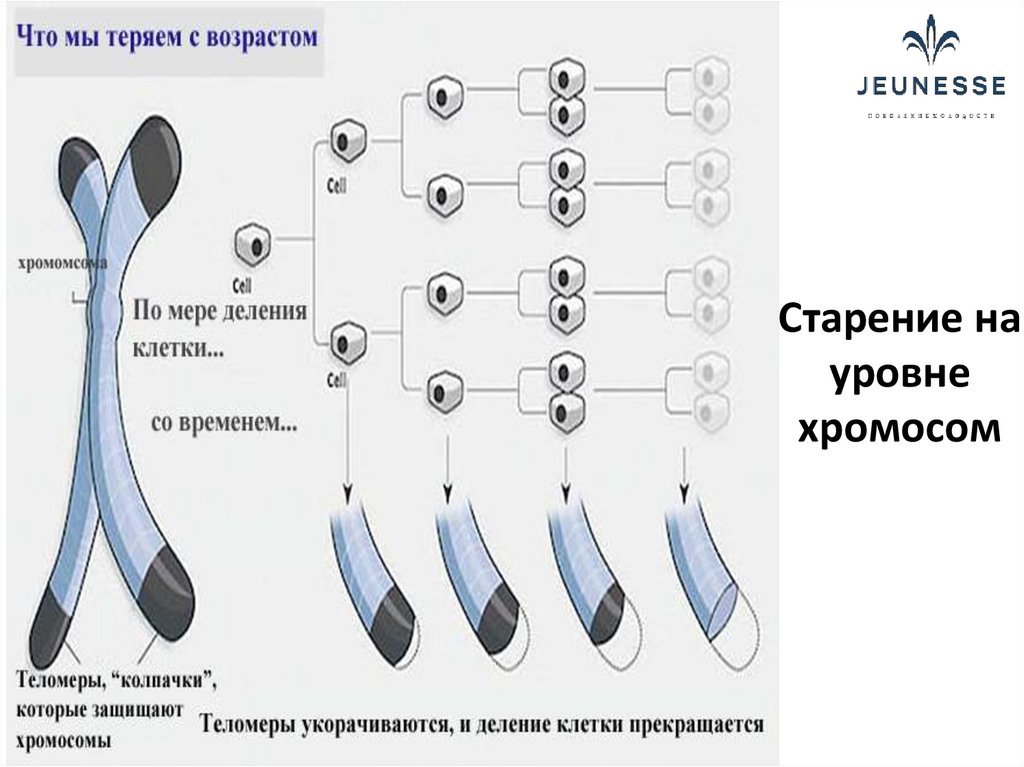
Что происходит с теломерами с возрастом?
- Каждый раз, когда клетка делится, на концах теломер каждой хромосомы теряется 25-200 оснований.
- Два основных фактора способствуют укорочению теломер во время клеточного деления:
- «Проблема конечной репликации» во время репликации ДНК: Объясняет потерю около 20 пар оснований при клеточном делении.

- Окислительный стресс: Объясняет потерю от 50 до 100 пар оснований за одно деление клетки. Считается, что на количество окислительного стресса в организме влияют факторы образа жизни, такие как диета, курение и стресс.
- «Проблема конечной репликации» во время репликации ДНК: Объясняет потерю около 20 пар оснований при клеточном делении.
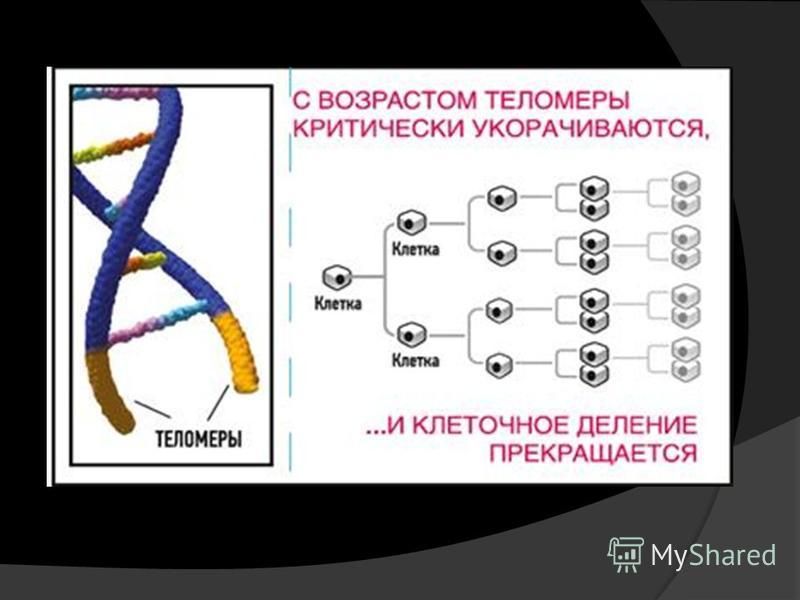
- Когда теломера становится слишком короткой, хромосома достигает «критической длины» и больше не может реплицироваться.
- Эта «критическая длина» вызывает гибель клетки в результате процесса, называемого апоптозом, также известного как запрограммированная гибель клетки.
Как поддерживается длина теломер?
- Теломераза представляет собой фермент, добавляющий последовательность теломер TTAGGG к концам хромосом.
- Теломераза обнаружена в очень низких концентрациях в наших соматических клетках. Поскольку эти клетки не используют регулярно теломеразу, они стареют, что приводит к снижению нормальной функции.
- Результатом старения клеток является старение организма.
- Теломераза обнаружена в больших количествах в клетках зародышевой линии (яйцеклетки и сперматозоиды) и стволовых клетках.
 В этих клетках длина теломер сохраняется после репликации ДНК, и клетки не проявляют признаков старения.
В этих клетках длина теломер сохраняется после репликации ДНК, и клетки не проявляют признаков старения. - Теломераза также обнаружена в больших количествах в раковых клетках. Это позволяет раковым клеткам быть бессмертными и продолжать воспроизводить себя. Если бы активность теломеразы была отключена в раковых клетках, их теломеры укорачивались бы, пока не достигли «критической длины». Это предотвратит бесконтрольное деление раковых клеток с образованием опухолей.
- Действие теломеразы позволяет клеткам продолжать размножаться и избегать старения.
Крышки теломер
Изображение предоставлено: Программа генома человека Министерства энергетики США. Лицензировано как общественное достояние через Wikimedia Commons.
Использование теломер в медицине
- Исследования теломер и роли теломеразы могут дать ценную информацию для борьбы со старением и раком.
- Медицинское значение теломер неясно.
- Клетки человека, культивируемые в лаборатории, прекращают делиться, когда теломераза инактивируется, потому что длина теломер не сохраняется после клеточного деления.

- Затем клетки переходят в состояние бездействия, называемое старением. Однако после реактивации теломеразы клетки могут продолжать делиться.
- Если теломеразу можно использовать, чтобы помочь клеткам человека жить вечно, возможно также массовое производство клеток для трансплантации. Эти клетки могут помочь в лечении целого ряда состояний, от тяжелых ожогов до диабета.
Теломеры и старение
- На моделях мышей с отсутствием фермента теломеразы были обнаружены признаки преждевременного старения.
- Однако неясно, является ли укорочение теломер ответственным за старение человека или это просто признак старения, такой как седые волосы.
- Есть несколько указаний на то, что длина теломер является хорошим предиктором продолжительности жизни.
- Новорожденные дети, как правило, имеют теломеры длиной от 8000 до 13000 пар оснований. Было замечено, что это число имеет тенденцию к снижению примерно на 20-40 пар оснований каждый год.
 Таким образом, к 40 годам теломеры могут потерять до 1600 пар оснований.
Таким образом, к 40 годам теломеры могут потерять до 1600 пар оснований. - Однако, глядя на картину в целом, общее укорочение наших теломер не является значительным даже у очень старых людей.
- Быстро делящиеся клетки, такие как зародышевые клетки и стволовые клетки, являются одними из немногих типов клеток в нашем организме, содержащих активную теломеразу.
- Это означает, что в этих клетках длина теломер сохраняется или даже удлиняется с течением времени.
- Однако существует ряд других факторов, влияющих на длину наших теломер, которые необходимо учитывать, например, курение и ожирение.
Теломеры и рак
- Теломеры и теломераза представляют собой ряд потенциальных мишеней для разработки новых методов лечения рака.
- Раковые клетки содержат активную теломеразу, позволяющую им стать «бессмертными» и продолжать бесконтрольно делиться.
- Рак — это заболевание, характеризующееся быстрым и неконтролируемым делением клеток.

- Без активности теломеразы эти клетки стали бы неактивными, перестали бы делиться и, в конце концов, погибли бы.
- Лекарства, которые ингибируют активность теломеразы или убивают клетки, продуцирующие теломеразу, потенциально могут останавливать и убивать раковые клетки на своем пути.
- Однако блокирование активности теломеразы может повлиять на клетки, в которых активность теломеразы важна, например, сперматозоиды, яйцеклетки, тромбоциты и иммунные клетки.
- Нарушение теломеразы в этих типах клеток может повлиять на фертильность, заживление ран и способность бороться с инфекциями.
- Однако активность теломеразы в соматических клетках очень низкая. Таким образом, эти клетки практически не будут затронуты антителомеразной терапией.
- Ученые надеются, что это приведет к меньшему количеству побочных эффектов для пациента по сравнению с современными методами лечения рака.
- Биология теломер невероятно важна при раке человека, и ученые усердно работают над тем, чтобы найти лучший способ использовать свои знания о ней для улучшения лечения рака.

Последнее обновление этой страницы: 21 июля 2021 г.
Что такое теломеры? | MBInfo
Перейти к содержимому
Поиск:
Что такое теломеры?steve2018-01-25T11:04:14+08:30
Теломеры представляют собой короткие последовательности нуклеотидов, находящиеся на концах линейных хромосом, которые защищают генетическую информацию. У позвоночных теломеры имеют гексамерную последовательность TTAGGG.
Во время репликации ДНК двухцепочечная ДНК раскручивается, и ДНК-полимераза синтезирует новые цепи. Однако, поскольку ДНК-полимераза движется однонаправленно (от 5’ к 3’), непрерывно реплицироваться может только ведущая цепь. В случае отстающей цепи репликация ДНК носит прерывистый характер. У людей малые праймеры РНК прикрепляются к отстающей цепи ДНК, и ДНК синтезируется небольшими участками длиной около 100-200 нуклеотидов, которые называются фрагментами Окадзаки [1][2]. Праймеры РНК удаляют, заменяют ДНК и фрагменты Оказаки лигируют вместе. К концу отстающей цепи невозможно присоединить РНК-праймер, а это означает, что при каждом делении клетки будет теряться небольшое количество ДНК. Эта «проблема конечной репликации» имеет серьезные последствия для клетки, поскольку означает, что последовательность ДНК не может быть правильно воспроизведена с потерей генетической информации.
К концу отстающей цепи невозможно присоединить РНК-праймер, а это означает, что при каждом делении клетки будет теряться небольшое количество ДНК. Эта «проблема конечной репликации» имеет серьезные последствия для клетки, поскольку означает, что последовательность ДНК не может быть правильно воспроизведена с потерей генетической информации.
Чтобы предотвратить это, теломеры повторяются от сотен до тысяч раз на концах хромосом. Каждый раз, когда происходит клеточное деление, небольшая часть теломерных последовательностей теряется из-за проблемы конечной репликации, тем самым защищая генетическую информацию. В какой-то момент теломеры становятся критически короткими. Это истощение приводит к старению клеток, когда клетка не может делиться, или к апоптотической гибели клеток. Теломеры являются основой для предела Хейфлика, количества раз, которое клетка способна делиться до достижения старения [3].
Теломеры расположены на концах хромосом, где они помогают защитить ДНК от потери во время репликации.
Теломеры могут быть восстановлены с помощью фермента теломеразы, который удлиняет теломеры. Теломеразная активность обнаруживается в клетках, подвергающихся регулярному делению, таких как стволовые клетки и лимфоциты иммунной системы. Теломеры также могут быть удлинены с помощью альтернативного пути удлинения теломер (ALT). В этом случае теломеры не удлиняются, а переключаются между хромосомами путем гомологичной рекомбинации. В результате замены теломер один набор дочерних клеток будет иметь более короткие теломеры, а другой набор будет иметь более длинные теломеры. Путь АЛТ еще не до конца изучен, но он рассмотрен в [4].
Обратной стороной удлинения теломер является возможность неконтролируемого деления клеток и развития рака. Аномально высокая активность теломеразы была обнаружена в большинстве [5] [6] раковых клеток, а в не-теломеразных опухолях часто наблюдается активация пути АЛТ. Помимо потенциальной потери генетической информации, клетки с короткими теломерами подвержены высокому риску неправильной рекомбинации хромосом, что может привести к генетической нестабильности и анеуплоидии (аномальному числу хромосом).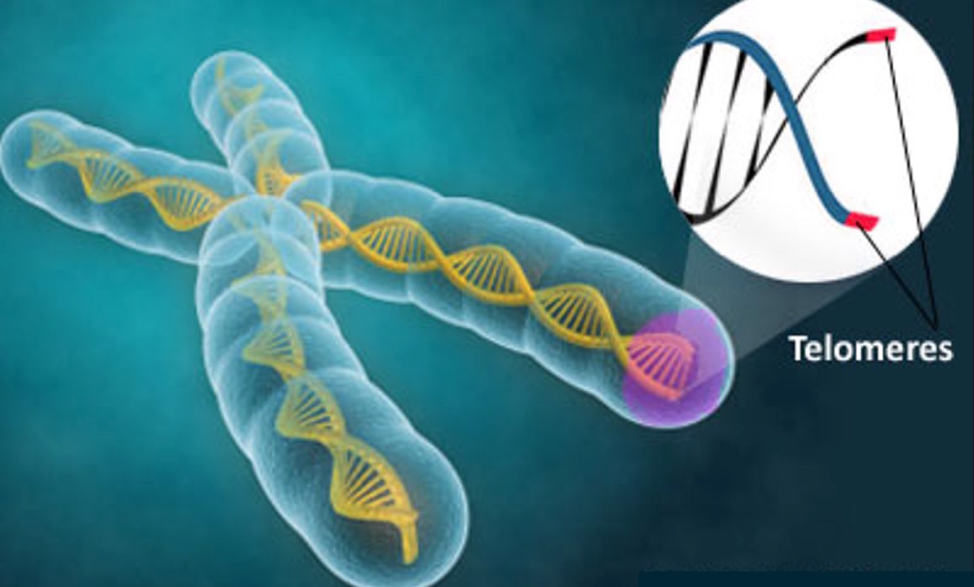
Клеточная геометрия играет важную роль в ядерной архитектуре и динамике хромосом, включая теломеры [7]. Недавняя работа показала, что механические силы могут регулировать пути, участвующие в поддержании целостности генома. ATR — это ядерный белок, который может обнаруживать повреждение ДНК. При осмотическом стрессе или механическом растяжении ATR перемещается к ядерной мембране, указывая на то, что ATR является механочувствительным, и это свойство помогает ему защищать ДНК от механических воздействий [8]. Кроме того, растяжение структуры тетраплекса теломер с помощью магнитного пинцета показало, что она существует в трех различных складчатых состояниях, которые имеют разное время жизни и механическую стабильность [9].]. Эти данные свидетельствуют о том, что механические силы влияют на роль теломер в защите генома и онкогенезе [10].
- Все
- Регулирование генома
Как ДНК упаковывается внутри ядра?
Должен происходить ряд процессов, позволяющих клетке упаковывать ДНК в пределах ядра, сохраняя при этом свою способность транскрибировать и дублировать всю последовательность ДНК и поддерживать ее целостность.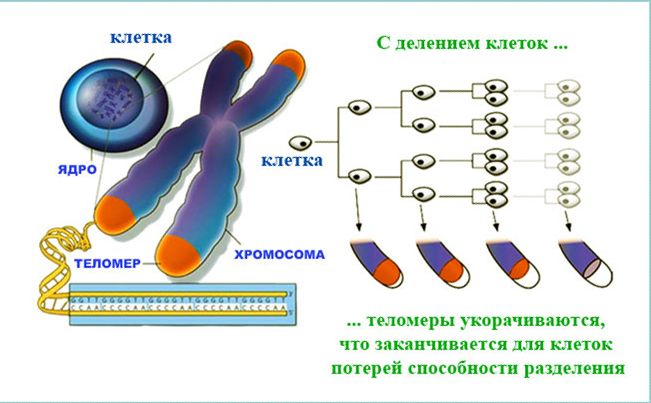 Это достигается за счет сложного процесса конденсации ДНК, при котором ДНК упаковывается в 46 хромосом (или 23 пары хромосом) у людей. Подробнее..
Это достигается за счет сложного процесса конденсации ДНК, при котором ДНК упаковывается в 46 хромосом (или 23 пары хромосом) у людей. Подробнее..
Как завершается перевод?Sruthi Jagannathan2017-12-19T16:53:50+08:30
Как завершается перевод?
Следующим шагом в процессе перевода является терминация. На этом этапе стоп-кодон мРНК указывает на то, что к растущему белку не следует добавлять дополнительные аминокислоты. Подробнее..
Как рибосомы рециклируются во время трансляции?Sruthi Jagannathan2017-12-19T16:50:22+08:30
Как рибосомы рециклируются во время трансляции?
Последним этапом трансляции является рециркуляция рибосомы, при которой рибосома разделяется на более мелкие субъединицы и готовится к следующему раунду трансляции. У эукариот это означает, что 80S рибосома расщепляется на 40S и 60S субъединицы. Подробнее..
Что происходит на этапе элонгации трансляции?Sruthi Jagannathan2017-12-19T16:46:46+08:30
Что происходит на стадии элонгации трансляции?
Элонгация происходит в несколько четко определенных этапов, начиная с распознавания кодонов мРНК соответствующей им аминоацил-тРНК.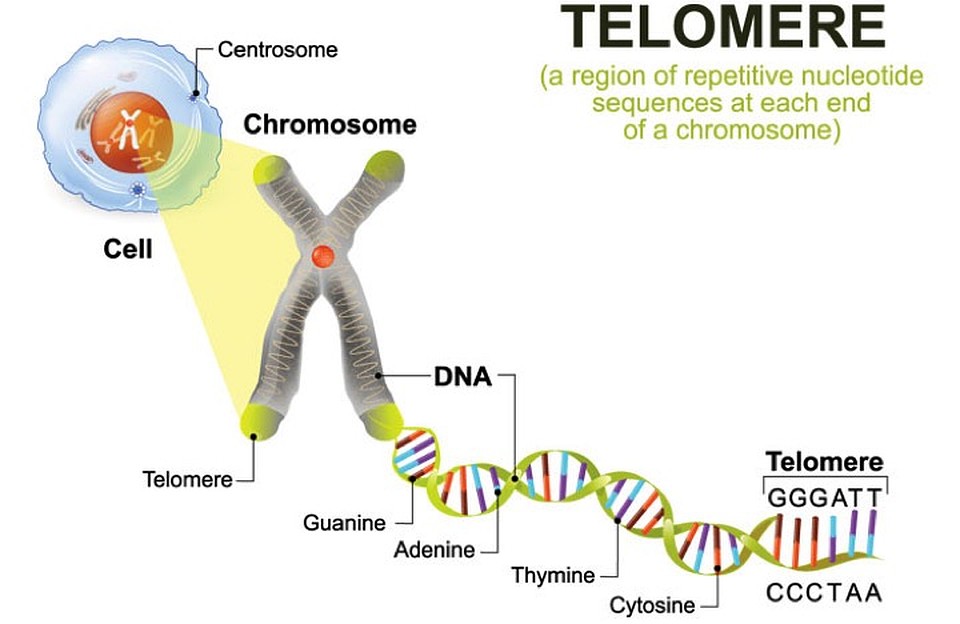 Ассоциация с мРНК происходит через сайт А рибосомы и зависит от различных факторов элонгации. Подробнее..
Ассоциация с мРНК происходит через сайт А рибосомы и зависит от различных факторов элонгации. Подробнее..
Как инициируется перевод?Sruthi Jagannathan2017-12-19T16:43:25+08:30
Как инициируется перевод?
Первый шаг в переводе известен как посвящение. Здесь большая (60S) и малая (40S) рибосомные единицы собираются в полностью функциональную 80S рибосому. Он расположен в стартовом кодоне (AUG) цепи мРНК, подлежащей трансляции. Подробнее..
Что такое перевод?Sruthi Jagannathan2017-12-19T16:02:08+08:30
Что такое перевод?
Трансляция — это процесс, включающий синтез цепочки аминокислот из схемы мРНК. Эти полипептидные цепи складываются в функциональные белки. Подробнее..
Что такое эухроматин и гетерохроматин?Sruthi Jagannathan2017-12-19T15:44:10+08:30
Что такое эухроматин и гетерохроматин?
Традиционно хроматин классифицируется как эухроматин или гетерохроматин, в зависимости от степени его уплотнения.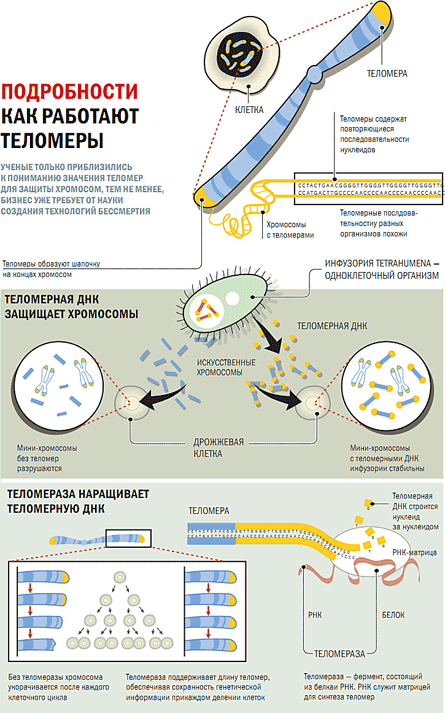 Эухроматин имеет менее компактную структуру и часто описывается как волокно длиной 11 нм, имеющее вид «бусинок на нитке», где бусинки представляют собой нуклеосомы, а нить представляет собой ДНК. Напротив, гетерохроматин более компактен, и часто сообщается, что он состоит из массива нуклеосом, сконденсированного в волокно размером 30 нм. Подробнее..
Эухроматин имеет менее компактную структуру и часто описывается как волокно длиной 11 нм, имеющее вид «бусинок на нитке», где бусинки представляют собой нуклеосомы, а нить представляет собой ДНК. Напротив, гетерохроматин более компактен, и часто сообщается, что он состоит из массива нуклеосом, сконденсированного в волокно размером 30 нм. Подробнее..
Что такое фабрики транскрипции?Sruthi Jagannathan2017-12-19T15:21:33+08:30
Что такое фабрики транскрипции?
Несмотря на то, что в каждом гаплоидном ядре присутствует 20 000 генов, количество очагов транскрипции ограничено примерно 2000. Эти очаги транскрипции, также известные как транскрипционные фабрики, представляют собой отдельные субмикронные ядерные области, которые связаны с зарождающейся продукцией РНК и обогащены РНК. комплексы полимеразы II (РНК pol II). Подробнее..
Что такое теломеры?Sruthi Jagannathan2017-12-19T15:14:11+08:30
Что такое теломеры?
Теломеры представляют собой короткие последовательности нуклеотидов, находящиеся на концах линейных хромосом, которые защищают генетическую информацию.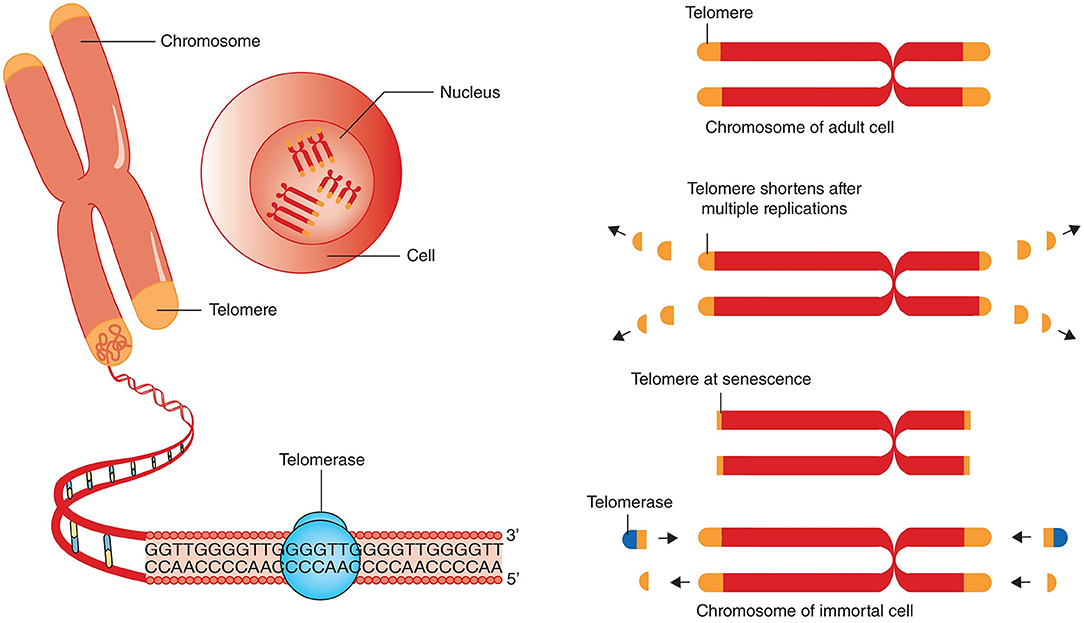 У позвоночных теломеры имеют гексамерную последовательность TTAGGG. Подробнее..
У позвоночных теломеры имеют гексамерную последовательность TTAGGG. Подробнее..
Какие существуют модели, описывающие структурную организацию хромосомных территорий?Sruthi Jagannathan2017-12-19T14:32:09+08:30
Какие различные модели описывают структурную организацию хромосомных территорий?
С развитием высокопроизводительных биохимических методов, таких как 3C («захват конформации хромосомы») и 4C («захват конформации хромосомы на чипе» и «захват конформации кольцевой хромосомы»), многочисленные пространственные взаимодействия между соседними хроматинами территории описаны. Вместе эти наблюдения и физическое моделирование привели к предложению различных моделей, направленных на определение структурной организации хромосомных территорий. Подробнее..
Как регулируется транскрипция в стволовых клетках?Sruthi Jagannathan2017-12-19T13:59:25+08:30
Как регулируется транскрипция в стволовых клетках?
Эмбриональные стволовые клетки являются плюрипотентными на ранних стадиях развития организма, но постепенно подвергаются линейной рестрикции и трансформируются в стволовые клетки с ограниченной способностью к дифференцировке (например, гемопоэтические стволовые клетки, нейральные стволовые клетки).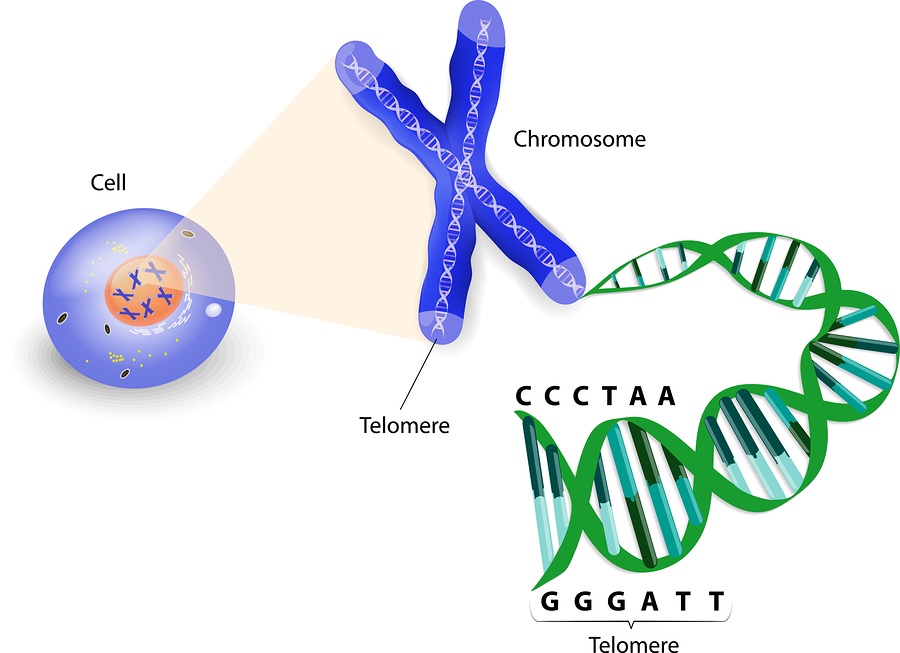 Подробнее..
Подробнее..
Как ядро поддерживается в предварительно напряженном состоянии?Sruthi Jagannathan2017-12-19T12:40:18+08:30
Как ядро поддерживается в предварительно напряженном состоянии?
Являясь неотъемлемой частью клеточного поведения, клетки чувствительны к жесткости матрицы, локальной геометрии и стрессу или деформации, вызванным внешними факторами. В последние годы было установлено, что обширная сеть сборки белков связывает цитоскелет с ядром и что силы конденсации хроматина уравновешивают силы цитоскелета, что приводит к предварительно напряженной организации ядра. Подробнее..
Какие стадии репликации ДНК?Sruthi Jagannathan2017-12-18T16:17:47+08:30
Какие стадии репликации ДНК?
Клетки должны реплицировать свою ДНК, прежде чем они смогут делиться. Это гарантирует, что каждая дочерняя клетка получит копию генома, а значит, и успешное наследование генетических признаков. Репликация ДНК является важным процессом, и основной механизм сохраняется во всех организмах. Подробнее..
Репликация ДНК является важным процессом, и основной механизм сохраняется во всех организмах. Подробнее..
Как ремоделирование хроматина регулирует транскрипцию генов?Sruthi Jagannathan2017-12-18T15:53:34+08:30
Как ремоделирование хроматина регулирует транскрипцию генов?
Хотя считается, что динамика хромосомной территории регулирует экспрессию генов посредством перераспределения генов и последующей совместной локализации этих генов с механизмом транскрипции, изменения в структуру хромосом также обычно вносятся на «локальном» уровне. Хотя эти изменения не обязательно связаны с перераспределением генов, они оказывают существенное влияние на регуляцию генов. Подробнее..
Как динамика территории хромосом регулирует экспрессию генов?Sruthi Jagannathan2017-12-18T15:22:28+08:30
Как динамика территории хромосом регулирует экспрессию генов?
Пространственная организация хроматина в трехмерном пространстве хромосомной территории обеспечивает совместную локализацию совместно транскрибируемых генов и их транскрипционных очагов.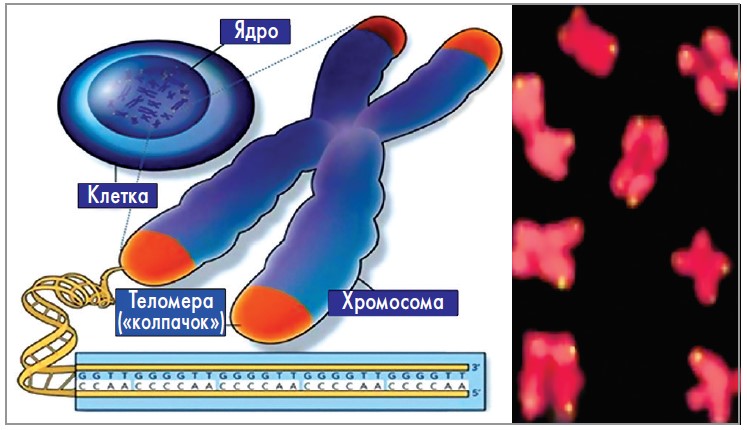 Многие исследования позиционирования генов показали, что отдельные гены часто выходят за пределы своей хромосомной территории, чтобы совместно локализоваться с транскрипционными фабриками. Подробнее..
Многие исследования позиционирования генов показали, что отдельные гены часто выходят за пределы своей хромосомной территории, чтобы совместно локализоваться с транскрипционными фабриками. Подробнее..
Что такое хроматин-полимерная модель организации хромосомной территории?steve2018-01-19T15:08:09+08:30
Что такое хроматин-полимерная модель организации хромосомной территории?
Модели полимеров хроматина предполагают широкий диапазон размеров петель хроматина и предсказывают наблюдаемые расстояния между геномными локусами и хромосомными территориями, а также вероятности образования контактов между данными локусами. В этих моделях применяются подходы, основанные на физике, которые подчеркивают важность энтропии для понимания организации ядра… Подробнее…
Что такое модель организации хромосомной территории Фрейзера и Бикмора?steve2018-01-19T15:06:27+08:30
Что такое модель организации хромосомной территории Фрейзера и Бикмора?
Модель Фрейзера и Бикмора подчеркивает функциональную важность гигантских петель хроматина, которые происходят из хромосомных территорий и расширяются по ядерному пространству, чтобы разделить фабрики транскрипции. В этом случае как цис-, так и транс-петли деконденсированного хроматина могут коэкспрессироваться и совместно регулироваться одной и той же транскрипционной фабрикой… Подробнее…
В этом случае как цис-, так и транс-петли деконденсированного хроматина могут коэкспрессироваться и совместно регулироваться одной и той же транскрипционной фабрикой… Подробнее…
Что представляет собой модель интерхроматиновой сети (ICN) организации хромосомной территории?steve2018-01-19T15:12:33+08:30
Что представляет собой модель интерхроматиновой сети (ICN) организации хромосомной территории?
Модель интерхроматиновой сети (ICN) организации хромосомной территории предсказывает, что переплетающиеся хроматиновые волокна/петли могут создавать как цис- (внутри одной хромосомы), так и транс- (между разными хромосомами) контакты. Такое смешение является равномерным и делает различие между хромосомной территорией и интерхроматиновым компартментом функционально бессмысленным… Подробнее…
Какие модели описывают хромосомные территории?steve2018-01-19T15:13:49+08:30
Какие модели описывают хромосомные территории?
С развитием высокопроизводительных биохимических методов, таких как 3C («захват конформации хромосомы») и 4C («захват конформации хромосомы на чипе» и «захват конформации кольцевой хромосомы»), многочисленные пространственные взаимодействия между соседними хроматинами территории описаны. Эти описания были дополнены построением карт пространственной близости для всего генома (например, для линии лимфобластоидных клеток человека). В совокупности эти наблюдения и физическое моделирование привели к предложению различных моделей, направленных на определение структурной организации хромосомных территорий… Подробнее…
Эти описания были дополнены построением карт пространственной близости для всего генома (например, для линии лимфобластоидных клеток человека). В совокупности эти наблюдения и физическое моделирование привели к предложению различных моделей, направленных на определение структурной организации хромосомных территорий… Подробнее…
Что такое хромосомные территории?steve2017-12-19T14:06:59+08:30
Что такое хромосомные территории?
Во время интерфазы каждая хромосома занимает пространственно ограниченный, примерно эллиптический домен, известный как территория хромосом (CT). Каждая хромосомная территория состоит из единиц хроматина более высокого порядка размером ~ 1 Мб каждая. Эти единицы, вероятно, построены из меньших петлевых доменов. Подробнее..
Что такое нуклеосомы?steve2017-12-19T14:52:22+08:30
Что такое нуклеосомы?
Чтобы поместить ДНК в ядро, она должна быть упакована в очень компактную структуру, известную как хроматин.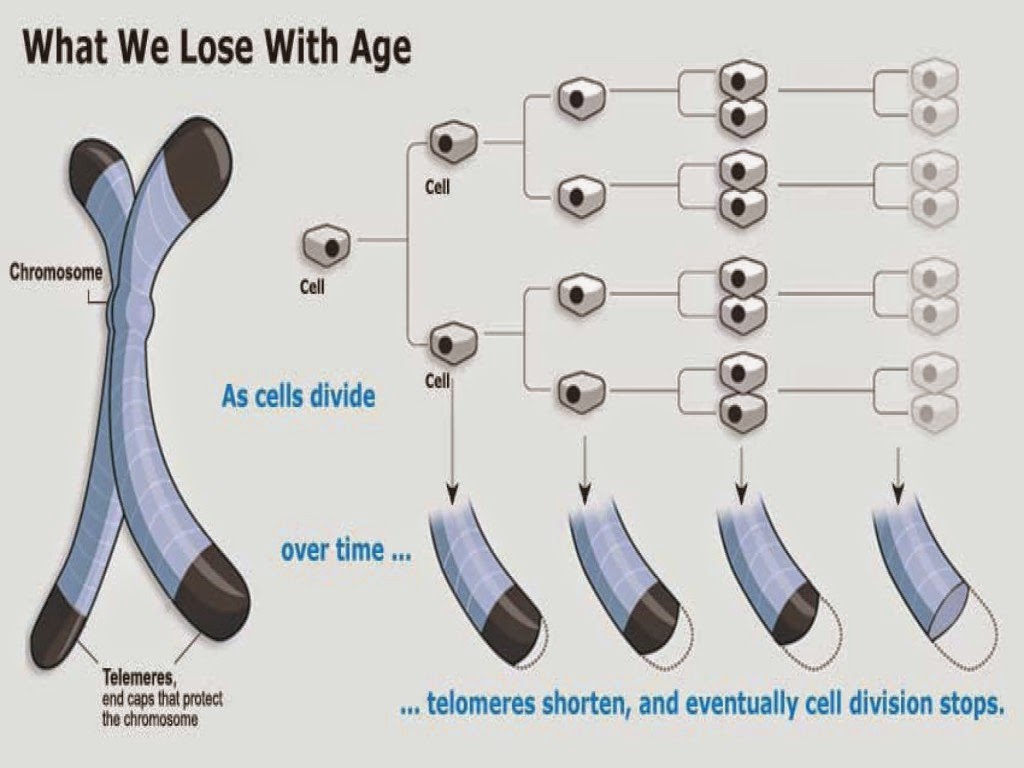 На первом этапе этого процесса ДНК конденсируется в волокно длиной 11 нм, что соответствует примерно 6-кратному уровню уплотнения. Это достигается за счет сборки нуклеосом. Подробнее..
На первом этапе этого процесса ДНК конденсируется в волокно длиной 11 нм, что соответствует примерно 6-кратному уровню уплотнения. Это достигается за счет сборки нуклеосом. Подробнее..
Как упаковывается ДНК внутри ядра?steve2017-12-19T15:34:48+08:30
Как упаковывается ДНК внутри ядра?
Должен происходить ряд процессов, позволяющих клетке упаковывать ДНК в пределах ядра, сохраняя при этом свою способность транскрибировать и дублировать всю последовательность ДНК и поддерживать ее целостность. Это достигается за счет сложного процесса конденсации ДНК, при котором ДНК упаковывается в 46 хромосом (или 23 пары хромосом) у людей. Подробнее..
Из чего состоит геном?steve2018-01-19T15:32:19+08:30
Из чего состоит геном?
Геном человека содержит более 3 миллиардов пар оснований или нуклеотидов. Эти нуклеотиды, расположенные в линейной последовательности вдоль ДНК (дезоксирибонуклеиновая кислота), кодируют каждый белок и генетический признак в организме человека… Подробнее…
Как цитоскелет влияет на морфологию и расположение ядер?steve2018-01-19T16:12 :40+08:30
Как цитоскелет влияет на морфологию и расположение ядер?
Работа Mazumder et al. установлено активное участие цитоскелетных сил в детерминации ядерной морфологии. Изменение размера ядра при возмущении актомиозина и микротрубочек подтвердило их роль в воздействии сил растяжения и сжатия соответственно на ядро, что коррелирует с их функциями в клеточном контексте, … Читать далее…
установлено активное участие цитоскелетных сил в детерминации ядерной морфологии. Изменение размера ядра при возмущении актомиозина и микротрубочек подтвердило их роль в воздействии сил растяжения и сжатия соответственно на ядро, что коррелирует с их функциями в клеточном контексте, … Читать далее…
Как цитоскелет соединяет плазматическую мембрану с ядром?steve2018-01-19T16:24:16+08:30
Как цитоскелет соединяет плазматическую мембрану с ядром?
Цитоскелетные филаменты связывают ядро с плазматической мембраной, которая, в свою очередь, прикрепляется в субклеточных участках к внеклеточным субстратам с помощью множества белков, образующих фокальные адгезии (FA). ЖК представляют собой точки перекрестного взаимодействия между трансмембранными интегриновыми рецепторами и цитоплазматическими филаментами и, таким образом, являются ключевыми местами как для биохимических, так и для механотрансдукционных путей… Подробнее…
Как регулируются организация и функции генома?steve2017-12-18T14:43:41+08:30
Как регулируются организация и функции генома?
Регуляция генома охватывает все аспекты экспрессии генов, от биохимических модификаций ДНК до физического расположения хромосом и активности механизмов транскрипции. Регуляция генома программирует, чтобы клетки контролировали, какие белки вырабатываются и на каком уровне . Программы устанавливаются во время дифференцировки стволовых клеток и, следовательно, диктуют специализированные функции, которые клетка будет выполнять на протяжении всей своей жизни… Подробнее…
Регуляция генома программирует, чтобы клетки контролировали, какие белки вырабатываются и на каком уровне . Программы устанавливаются во время дифференцировки стволовых клеток и, следовательно, диктуют специализированные функции, которые клетка будет выполнять на протяжении всей своей жизни… Подробнее…
Что такое промежуточные структуры хроматина?Эндрю Вонг2017-12-19T15:02:43+08:30
Что такое промежуточные структуры хроматина?
Несмотря на обширные знания, уже полученные о структуре нуклеосомного волокна 11 нм, а также о метафазных хромосомах, обычно описываемые структуры промежуточного хроматина в значительной степени гипотетичны и еще предстоит наблюдать in vivo. Две популярные модели, которые были предложены на основе in vitro данные имеют соленоид и зигзаг. Подробнее..
Просмотреть все
Последние находки
Ссылки
- Сакабе К. и Оказаки Р.
 Уникальное свойство реплицирующейся области хромосомной ДНК. Биохим. Биофиз. Акта 1966 года; 129(3):651-4. [PMID: 5337977]
Уникальное свойство реплицирующейся области хромосомной ДНК. Биохим. Биофиз. Акта 1966 года; 129(3):651-4. [PMID: 5337977] - Okazaki R, Okazaki T, Sakabe K, and Sugimoto K. Механизм репликации ДНК, возможный разрыв цепи ДНК. Япония. Дж. Мед. науч. биол. 1967 год; 20(3):255-60. [PMID: 4861623]
- ХЕЙФЛИК Л. ОГРАНИЧЕННОЕ ВРЕМЯ ЖИЗНИ IN VITRO ШТАММОВ ДИПЛОИДНЫХ КЛЕТОК ЧЕЛОВЕКА. Эксп. Сотовый рез. 1965; 37:614-36. [PMID: 14315085]
- Чезаре А.Дж. и Реддель Р.Р. Альтернативное удлинение теломер: модели, механизмы и последствия. Нац. Преподобный Жене. 2010 г.; 11(5):319-30. [PMID: 20351727]
- Стюарт С.А. и Вайнберг Р.А. Теломеры: от рака к старению человека. Анну. Преподобный Cell Dev. биол. 2006 г.; 22:531-57. [PMID: 16824017]
- Ким Н.В., Пятишек М.А., Проуз К.Р., Харли С.Б., Уэст М.Д., Хо П.Л., Ковиелло Г.М., Райт В.Е., Вайнрих С.Л. и Шей Д.В. Специфическая ассоциация активности теломеразы человека с бессмертными клетками и раком. Наука 1994; 266(5193):2011-5.

 Если бы теломер не было, наши хромосомы могли бы прилипнуть к другим хромосомам.
Если бы теломер не было, наши хромосомы могли бы прилипнуть к другим хромосомам.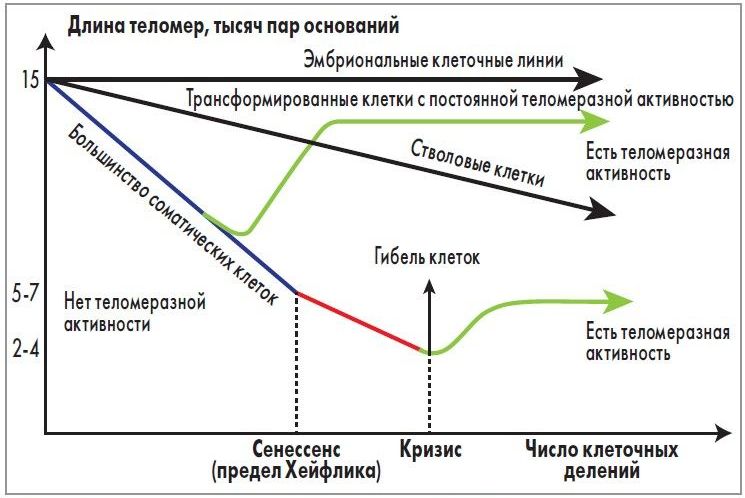
 В этих клетках длина теломер сохраняется после репликации ДНК, и клетки не проявляют признаков старения.
В этих клетках длина теломер сохраняется после репликации ДНК, и клетки не проявляют признаков старения.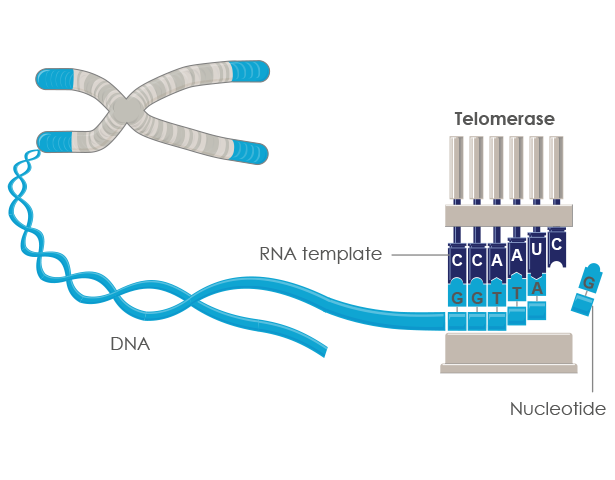
 Таким образом, к 40 годам теломеры могут потерять до 1600 пар оснований.
Таким образом, к 40 годам теломеры могут потерять до 1600 пар оснований.