Кератин в косметике
Супер цена на товар недели!
#Кератин 15х9 мл
#Базовая маска 2500 мл + в подарок комплект с 10 баночками
#Эластин 15х9 мл
Кератин в косметике
Интервью с профессором Сапожниковой А.И.
В последние годы белок кератин стал широко известен благодаря массированной рекламе средств по уходу за волосами. Сегодня он – средство №1 в борьбе за красоту и здоровье наших волос. Шампуни, бальзамы, маски и сыворотки с добавлением этого белка пользуются повышенным спросом, поэтому производители охотно включают его в свои рецептуры. Однако кератин кератину рознь, и оценить качество сырья, равно как и его действенность в составе конечного продукта – далеко не простая задача. О том, как работает кератин в косметике и как из множества предложений на рынке выбрать наиболее выгодное, мы беседуем с ученым, много лет возглавлявшим старейшую российскую фирму по производству косметических белков, доктором технических наук, профессором Аллой Ионовной Сапожниковой.
Вопрос: Алла Ионовна, вам принадлежит не только идея производства косметических белков, вы – автор запатентованных технологий их получения. Расскажите, пожалуйста, как все начиналось?
Ответ: Технологии получения косметических белков из животного сырья были разработаны в 70-90-х годах группой ученых из Московской ветеринарной академии им. К.И. Скрябина. Перед нашим научным коллективом, который возглавлял профессор Сергей Каспарьянц, стояла важнейшая задача: найти способы извлечения прибыли из отходов кожевенного, шерсте- и мясоперерабатывающего производств. В них содержалось ценнейшее сырье – белки: коллаген, эластин и кератин. Однако в процессе переработки белки разрушались. Советские ученые (в числе разработчиков была и я) придумали, как извлечь белки, сохранив неповрежденной их молекулярную структуру.
В 1991 году, когда в стране начался экономический развал, мы с коллегами открыли фирму СИНАП по выпуску белкового сырья для косметической индустрии России и стран СНГ.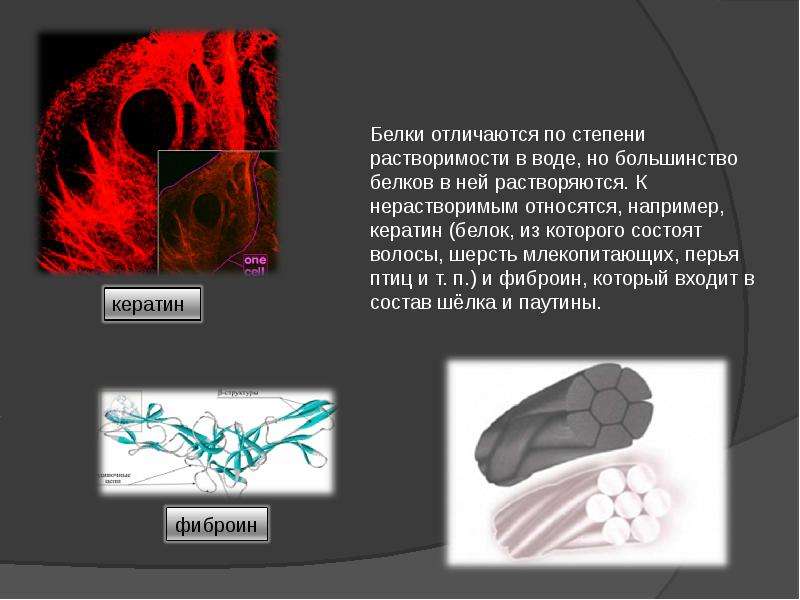 Нашу продукцию стали приобретать такие известные производители как фабрика «Свобода», «Самарский парфюмерный комбинат» преобразованный затем в ПКК «Весна», фирма «Саша», компании «Kora», «Лорен-косметик», «Viorica Cosmetic» и многие другие. В 2017 году фирма прошла через ребрендинг и теперь называется ЛАОНА ЛАБ. Мы выпускаем нашу продукцию уже более четверти века, и, насколько мне известно, остаемся единственным российским производителем косметических белков в чистом виде, а не в составе косметических средств.
Нашу продукцию стали приобретать такие известные производители как фабрика «Свобода», «Самарский парфюмерный комбинат» преобразованный затем в ПКК «Весна», фирма «Саша», компании «Kora», «Лорен-косметик», «Viorica Cosmetic» и многие другие. В 2017 году фирма прошла через ребрендинг и теперь называется ЛАОНА ЛАБ. Мы выпускаем нашу продукцию уже более четверти века, и, насколько мне известно, остаемся единственным российским производителем косметических белков в чистом виде, а не в составе косметических средств.
Вопрос: Расскажите, пожалуйста, о кератине. Чем ваша продукция отличается от представленных на рынке аналогов?
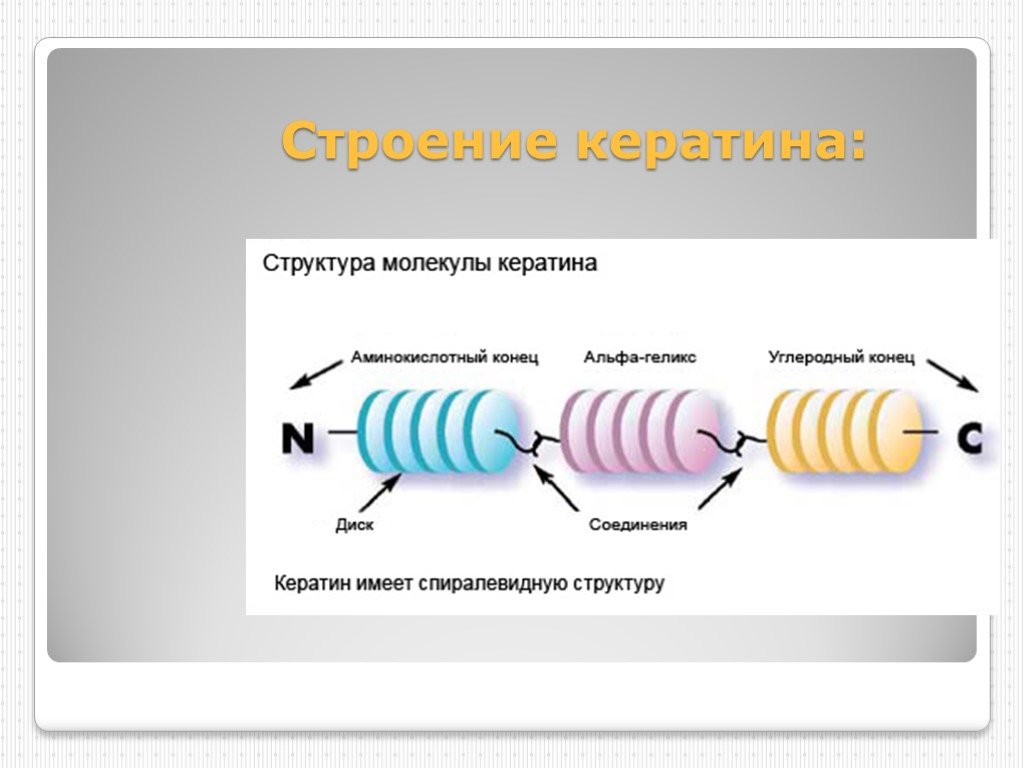
Ответ: Кератин – это фибриллярный белок животного происхождения, структурный протеин волос. От него зависят прочность и эластичность наших волос, а также их внешний вид: плотность, объем, блеск.
Косметический кератин мы получаем из овечьей шерсти, которую подвергают многократной очистке, чтобы избавиться от компонентов, способных вызвать аллергии и другие осложнения. Конечный продукт – высокоочищенный молекулярно-диспергированный препарат кератина с содержанием основного компонента до 95-98 % от массы сухого остатка.
Конечный продукт – высокоочищенный молекулярно-диспергированный препарат кератина с содержанием основного компонента до 95-98 % от массы сухого остатка.
Способ получения растворимой формы фибриллярного кератина из волокон шерстяного очеса был запатентован нами в 1997 году. Он предполагает обработку сырья особыми смесями, которые, энергично действуя на волос, нарушают связи в его фибрилярных структурах, и высвобождают макромолекулы кератина. Если обработку продолжать – белок гидролизуется – распадется на отдельные аминокислоты, из которых и состоит. То есть фактически перестанет быть кератином, и утратит свойства полноценного белка.
Такой полностью разрушенный белок – гидролизат кератина (Hydrolyzed Keratin) – широко используют в средствах для волос. В шампуни, маски и бальзамы, которые можно найти на полках магазинов, обычно добавлен именно гидролизат.
Но кератин, произведенный в ЛАОНА ЛАБ имеет принципиальное отличие – он имеет ту же молекулярную структуру, что и белок, синтезированный в нашем организме.
Вопрос: Почему это так важно?
Ответ: Потому, что только натуральные белки, сохраняют свою биологическую активность. Косметический кератин ЛАОНА ЛАБ – это полноценный белок, солюбилизированный до уровня макромолекул и имеющий природное сродство с аналогичными структурными элементами наших волос. Вот почему он может восстанавливать их, в отличие от гидролизованного кератина, который, распавшись на отдельные фрагменты, теряет свою биоактивность. «Осколки» белка не могут эффективно связываться с волосами и восстанавливать поврежденную кутикулу. К такому выводу сегодня пришли многие ученые. Недавно, об этом заявил в своем интервью глава компании Global Keratin господин Ван Тиболли, сообщив, что по их данным гидролизат кератина в восстановлении волос неэффективен.
Вопрос: Вы сказали, что макромолекулы кератина, в отличие от гидролизованного белка, сохраняют свою биологическую активность. Это научно доказанный факт или просто версия?
Ответ: Это факт.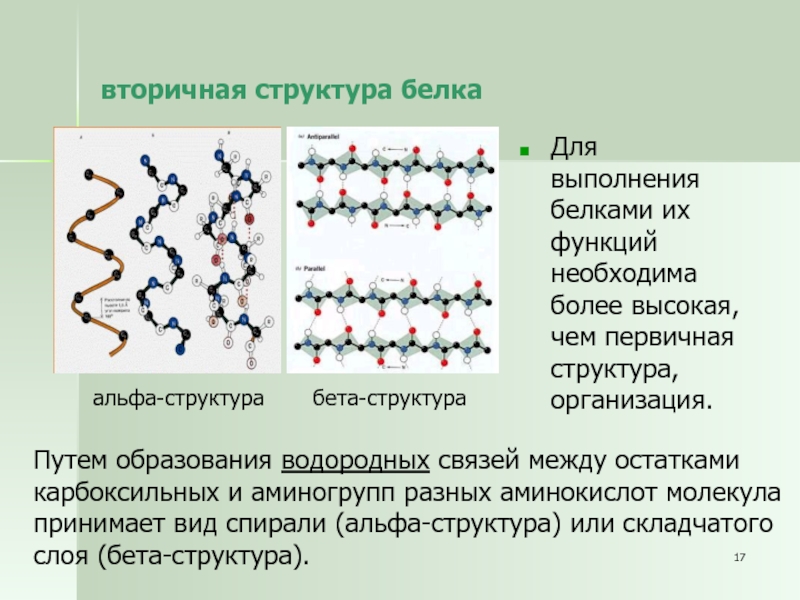 Гистологическая экспертиза образцов кожи, полученных путем биопсии (биоптатов), подтвердила биологическую активность нашего препарата. В ходе исследования было отмечено образование новых фибробластов в дерме, расширение устьев волосяных фолликулов, влагоудерживающий эффект.
Гистологическая экспертиза образцов кожи, полученных путем биопсии (биоптатов), подтвердила биологическую активность нашего препарата. В ходе исследования было отмечено образование новых фибробластов в дерме, расширение устьев волосяных фолликулов, влагоудерживающий эффект.
Установлено также, что экспериментальные водно-масляные эмульсии, содержащие кератин, на 37-65% стимулировали рост шерсти лабораторных животных по сравнению с контрольной группой.
Вопрос: Но если гидролизат неэффективен, почему же его продолжают производить и добавлять в косметические средства?
Ответ: Думаю, здесь две причины. Во-первых, соблазнительна простота; поместить белковое сырье в автоклав и сделать из него аминокислотный «суп» – довольно легко и дешево, никаких особых технологий для этого не требуется. Во-вторых, существует инерция общественного мнения, обработанного рекламой. Однако и производители, и потребители со временем обнаружат отсутствие обещанного эффекта, и тогда преимущество будет у тех, кто вовремя сориентировался, перейдя на полноценное белковое сырье.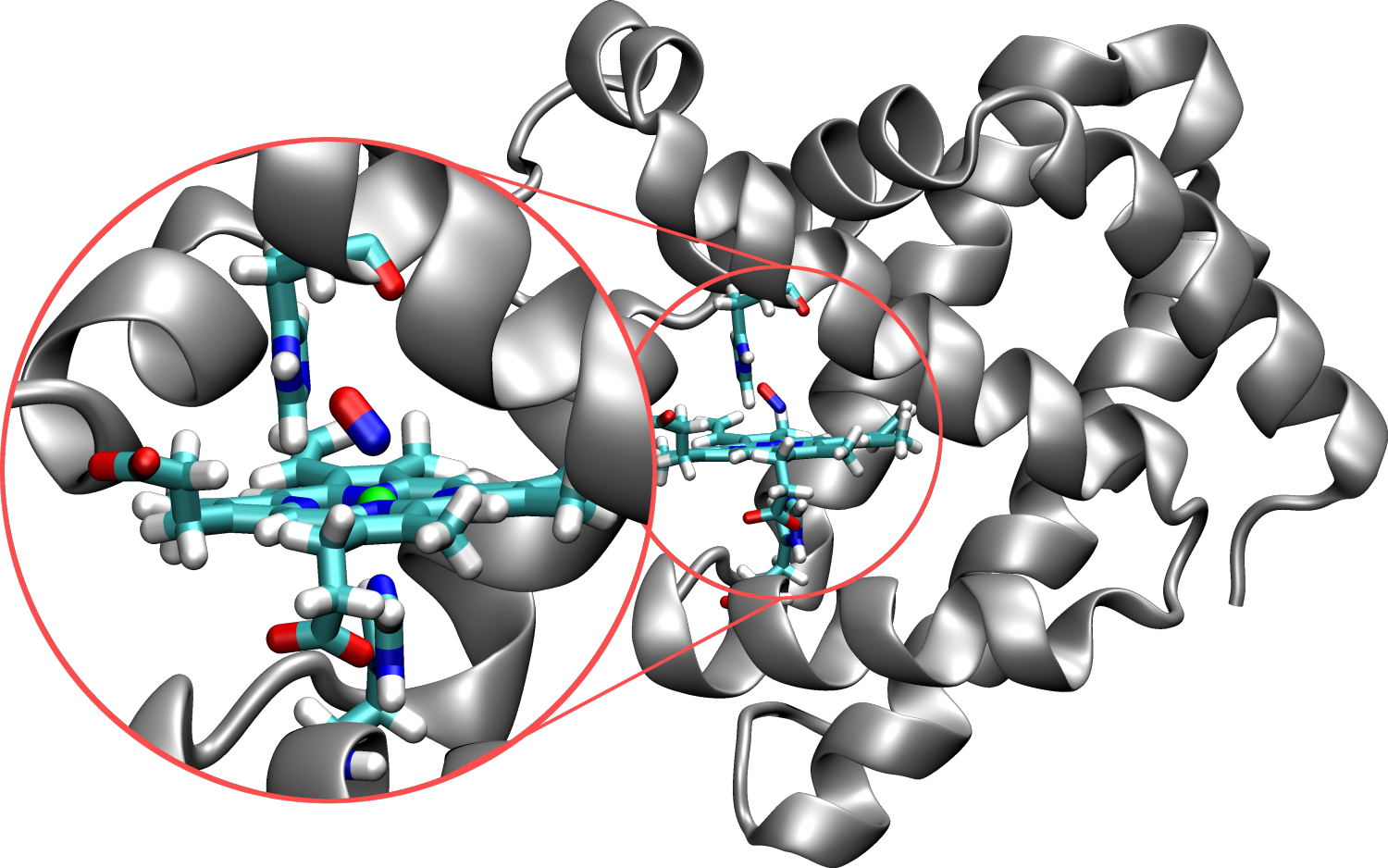
Вопрос: Как косметический кератин взаимодействует с волосами?
Ответ: Несмотря на видовую специфику, волосы человека и животных близки по химической природе и относятся к большому классу гомологичных белковых веществ – твердым альфа-кератинам млекопитающих. Благодаря высокому сродству с кератином наших волос, косметический белок восстанавливает барьерную структуру волоса, пострадавшую от негативных воздействий среды. Происходит это так: молекулы микрофибриллярного кератина встраиваются в структуру поврежденной кутикулы, образуя новые поперечные водородные связи со свободными активными функциональными группами наших собственных протеинов волоса.
Адсорбированный на повреждённых участках кутикулы кератин, заполняет ее пустоты, склеивает чешуйки. Этот эффект хорошо заметен на фотографиях волоса, сделанных с помощью электронного микроскопа, дающего увеличение в 5 тысяч раз. Подчеркиваю, речь идет только о нативном белке – то есть натуральном, не повреждённом, сохраняющем трехспиральную структуру молекулы, присущую кератину в живой ткани.
Вопрос: Существуют ли научные исследования, подтверждающие эффективность кератина?
Ответ: Конечно. Несколько лет назад мы провели масштабные клинические испытания на 110 добровольцах всей нашей продукции, в том числе и кератина. Исследования проходили в Институте красоты на Арбате с 2006 по 2012 годы. Для испытаний использовали кератин, произведенный нашей фирмой. Он был включен в рецептуры шампуня и бальзама для волос, разработанные в ЗАО «Косметологическая лечебница «Институт красоты» из расчета: 3-10% от общего объема косметического изделия.
Опытные партии средств с кератином апробировали на сухих, нормальных и жирных волосах. Для контроля использовали шампунь и бальзам аналогичной рецептуры без кератина.
Моющий эффект оценивали, исследуя чешуйчатый слой волос каждого типа под электронным микроскопом, дающим увеличение в 5000 раз. Степень поглощения кератина волосами определяли, измеряя абсолютно сухую массу волос по окончании процедуры. На заключительном этапе исследований волосы проверили на прочность, подвергнув их разрывной нагрузке.
На заключительном этапе исследований волосы проверили на прочность, подвергнув их разрывной нагрузке.
Вопрос: И каков же результат?
Ответ: В ходе клинических испытаний было установлено, что у поврежденных волос сухого и нормального типа нормализовалась структура кутикулы, поверхность чешуйчатого слоя выровнялась и стала выглядеть более однородной. Кроме того достоверно увеличилась жесткость кортекса, за счет уменьшения его пористости и относительного удлинения, что объективно сделало волосы более прочными.
Больше всего от применения шампуня и бальзама с кератином выиграли поврежденные волосы сухого и нормального типов – их прочность и способность к деформации приблизилась к аналогичным показателям здоровых волос, поскольку поврежденные участки кутикулы адсорбировали кератин. Замечу также, что волосы всех типов, помытые средствами без кератина, показали снижение прочности.
Вопрос: Объективные данные в виде снимков, сделанных электронным микроскопом, и результатов измерений – это убедительно. Но покупателей гораздо больше волнует не состояние кутикулы само по себе, а такие заметные простым глазом вещи, как блеск волос, их пышность, легкость в расчесывании и т.п. Принимались ли в расчет эти показатели?
Но покупателей гораздо больше волнует не состояние кутикулы само по себе, а такие заметные простым глазом вещи, как блеск волос, их пышность, легкость в расчесывании и т.п. Принимались ли в расчет эти показатели?
Ответ: Да. Были собраны и статистически обработаны субъективные оценки участников исследования – как пробантов, так и специалистов, которые сравнили эффективность средств с кератином и без него.
Пробантам было предложено оценить по 5-тибальной шкале потребительские свойства этих продуктов: запах, цвет, консистенцию, удобство применения и свои ощущения во время и после использования. Затем был рассчитан комплексный показатель качества для каждого продукта. Средняя оценка участниц средствам без кератина, составила для шампуня – 84,6 балла, а для бальзама – 83,7. В то время как шампунь с кератином был оценен волонтерами в 92,6 балла, а бальзам – 91,6.
В свою очередь врачи-дерматокосметологи оценили по 5-тибальной шкале такие показатели, как блеск волос, расчесываемость, пышность, электризуемость, легкость оформления в прическу и стойкость косметического эффекта. Средний балл, поставленный экспертами обычному шампуню и бальзаму – 3,4. А средства с кератином, по мнению экспертов, заслужили более высокой оценки – 4,2 балла.
Средний балл, поставленный экспертами обычному шампуню и бальзаму – 3,4. А средства с кератином, по мнению экспертов, заслужили более высокой оценки – 4,2 балла.
Вопрос: В СМИ часто встречаются высказывания о небезопасности косметических белков животного происхождения, а также об их высокой аллергенности. Существуют ли реальные основания для беспокойства? Проводились ли какие-либо исследования на этот счет.
Ответ: Да, проводились. Настороженное отношение к белкам животного происхождения возникло в последние годы в связи с распространением вируса губчатой энцифалопатии, известной как вирус коровьего бешенства. Однако интерес к кератину в профессиональной среде оказался столь высок, что некоторые фирмы, пользуясь истерией, поднятой в СМИ, пытаются продвинуть на рынок растительный аналог – так называемый «фитокератин», сопровождая свою кампанию далекими от науки заявлениями о «неоспоримых преимуществах растительного кератина» перед белком с сохраненной молекулярной структурой, полученным из овечьей шерсти.
В связи с этим хочу подчеркнуть, что кератин – это исключительно животный белок. И все разговоры о фитокератине – не более чем спекуляция продавцов косметики, лоббирующих интересы отдельных фирм-производителей.
Вернемся, однако, к вопросу о безопасности кератина от ЛАОНА ЛАБ. В отношении нашей продукции страхи совершенно беспочвенны. Во-первых, мы берем шерсть только от здоровых животных, каждое из которых проходит строгий ветеринарный контроль. Во-вторых, токсико-гигиенические испытания, проведенные в лабораторных условиях, показали, что косметический кератин безвреден. Он не оказывает кожно-раздражающего действия, не повышает чувствительность организма к химическим веществам и аллергенам, не повреждает слизистые оболочки глаза и роговицу. Качество нашего препарата подтверждено гигиеническим сертификатом.
Эти и другие документы, подтверждающие качество нашей продукции, а также подробные результаты клинических исследований размещены на сайте www.laonalab.com и доступны всем, кого интересуют подлинные научные данные.
Беседовала Анна Астахова
Материалы используется с разрешения www.cosmetic-industry.com
ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ КЕРАТИНОВОГО СОСТАВА ДЛЯ ВЫПРЯМЛЕНИЯ ВОЛОС KERATIN COMPLEX
Кератиновое выпрямление волос Keratin Complex.
Лечение может быть применимо для всех типов волос, для неокрашенных, а так же для химически обработанных волос (окрашенных, обесцвеченных, после химической завивки или после химического выпрямления).
Способ применения: Только для профессионального использования.
1. Вымойте волосы 2 раза Очищающим шампунем. После мытья шампунем не использовать кондиционер либо другое средство, облегчающее расчесывание.
2. Высушите волосы феном или естественным способом. Если волос сильно вьющийся или сильно поврежден, полностью высушивать не следует, достаточно тщательно вытереть полотенцем.
3. Примените минимум 40мл кератина Keratin Complex для обработки волос средней длины (регулируйте количество согласно длине и густоте волос).
Предупреждение: Использование состава меньше, чем минимально-необходимое количество, может привести к повреждению волос при термообработке утюгом.
Наденьте перчатки, хорошо встряхните бутылку с кератином, и вылейте необходимое количество продукта в миску.Разделите волосы на 4 секции. Начиная с затылка, аккуратно наносите продукт кисточкой, избегая любого контакта с кожей или глазами. Наносите состав, отступая 1 см. от корня, несколько раз трогая прядь кисточкой, а затем хорошо прочесывая состав по длине пряди частым гребнем, уделяя концам волос особое внимание. После обработки всей головы хорошо расчешите волосы и уберите излишки. Состава на волосах не должно быть слишком много. Не наносите состав повторно на уже подсохшие обработанные волосы, так как это будет только тратой продукта.
Дайте средству воздействовать 30 мин. После этого НЕ СМЫВАТЬ состав.
4. Оденьте перчатки. Используя щетку и начиная с затылка, сушите волосы феном, как это делаете всегда. Вы не должны сосредотачиваться на выпрямлении волос, только на высыхании состава на волосах. Высушите волосы на 100 %.
Высушите волосы на 100 %.
5. Подготовьте утюг, поддерживающий температуру нагрева 230°С (температура важна для процесса полимеризации) и частый гребень. Разделите волосы на 4 больших секции. Вы теперь готовы начать выпрямлять волосы. Начиная с области затылка, берите очень тонкие пряди. Помните, что чем тоньше прядь, тем лучше качество. Подхватывайте прядь частым гребнем и следом ведите по пряди утюгом, нагретым до 230°С. Рекомендуется проходить по пряди быстро — более предпочтительно количество повторений, чем задержка утюжка на пряди. Каждую прядь проходить 7-10 раз. Не волнуйтесь, что испортите утюгом волосы. Если Вы использовали правильное минимальное количество продукта, Вы не повредите и не сожжете волосы, поскольку кератин Keratin Complex содержит термозащиту.
НЕЛЬЗЯ (ПЕРВЫЕ 72 ЧАСА ПОСЛЕ ПРОЦЕДУРЫ):
1. Не мойте волосы в течение 3 дней.
2. Не связывайте волосы в хвост.
3. Не используйте заколки для волос.
4. Не используйте обручи для волос.
5. Не помещайте волосы позади ушей.
6. Не используйте очки, чтобы сдержать волосы.
7. Не носите шапку (используйте капюшон).
НЕЛЬЗЯ (ПО ИСТЕЧЕНИИ 72 ЧАСОВ):
1.Используйте Безсульфатный шампунь Keratin Complex.
2.Избегайте мочить волосы в морской воде и воде с хлором.
Общие рекомендации и разъяснения
1.Море. Соленая морская вода и хлорированная вода в бассейне способствует быстрому разрушению защитного слоя. Поэтому не мочите волосы, или будьте готовы к тому, что состав с волос быстро уйдет.
2.Шампунь. Мыть голову необходимо только безсульфатными шампунями. Обычные шампуни содержат соли, и они как и морская вода разрушат защитный слой. Не забывайте при посещении парикмахерской предупреждать мастера, что вам нельзя мыть голову обычным шампунем. Берите безсульфатный шампунь Keratin Complex с собой.
3.Окрашивание волос. Окрашивать волосы можно не раньше, чем через 1,5- 2 недели после процедуры. Если волосы требуют окрашивания, лучше это сделать за неделю до применения кератинового лечения.
4.Поврежденный или очень вьющийся волос. Если волос очень сильно поврежден, или имеет тугой мелкий завиток – волосы после мытья глубокоочищающим шампунем не сушите, а лишь хорошо вытрите полотенцем.
5.Меры предосторожности. Проводите процедуру вдали от детей, в хорошо проветриваемых, вентилируемых помещениях.
6.Беременным и кормящим процедура противопоказана.
Кератин — Протеопедия, жизнь в 3D
Из Протеопедии
Перейти к: навигация, поиск
Эта страница, появившаяся 12 сентября 2013 г., была показана в этой статье в журнале Biochemistry and Molecular Biology Education.
Примечание. Эта статья о кератинах была опубликована в журнале Biochem. Мол. биол. Образовательный [1] . Пожалуйста, цитируйте его как Биохим. Мол. биол. Образовательный 42:93-4, 2014.
Кератин — это название, данное большому семейству гомологичных белков, имеющих филаментную (волокнистую) структуру. Эти белки экспрессируются в эпителиальных клетках и в клетках эпидермиса, где они собираются, образуя цитоскелетные структуры внутри клетки и производные эпидермиса, такие как волосы, ногти и рога 9. 0011 [2] .
0011 [2] .
Кератины представляют самую большую ветвь в суперсемействе белков промежуточных филаментов (IF) [3] [4] . Кератины сгруппированы в два семейства, называемые кератинами типа I и типа II, на основании гомологии их последовательностей [5] . Сходным образом, другие белки IF также сгруппированы в семейства, называемые последовательно белками IF типов III, IV, V и VI, на основании гомологии их последовательностей [6] . Эти семейства включают десмин, виментин, белок нейрофиламентов и GFAP, которые экспрессируются в определенных тканях и типах клеток 9.0011 [3] . Ламины семейства IF расположены на ядерной пластинке и повсеместно экспрессируются [3] .
См. Кератин (иврит).
Содержимое
|
Промежуточные филаменты
В большинстве эукариотических клеток есть три основные системы цитоскелета: [7]
- Микрофиламенты, состоящие из актиновых субъединиц
- Промежуточные нити
- Микротрубочки, состоящие из субъединиц тубулина
Название «промежуточные филаменты» отражает сравнительную морфологию этих филаментов, так как их диаметр составляет около 8-12 нм; значение, являющееся «промежуточным» между микрофиламентами диаметром 6-7 нм и микротрубочками диаметром 25 нм [8] .
И микрофиламенты, и микротрубочки собраны из глобулярных субъединиц актина и тубулина соответственно. Напротив, промежуточные филаменты (IFs) состоят из белков, которые имеют длинную волокнистую структуру, которая является результатом длинных участков альфа-спиральных доменов.
Основным строительным блоком каждого промежуточного филамента является димер пары спирально-скрученных белков IF (см. Спиралевидная спираль). Каждая кератиновая нить собрана в виде гетеродимера кератина I типа, свернутого вместе с кератином II типа. [5] . Другие типы IF в основном состоят из гомодимеров [3] .
Первичные структуры кератинов
У человека существует 54 функциональных гена, кодирующих кератины [9] [10] . Первые последовательности кДНК кератина человека показали, что существует два различных, но гомологичных семейства кератина [5] [11] . Эти два различных типа были названы кератином I типа и кератином II типа [5] .
Секвенирование генома человека показало, что гены кератина типа I и типа II расположены в двух кластерах, каждый из которых включает 27 генов на хромосоме 17q21 и на хромосоме 12q13 соответственно [10] [12] . Соседнее расположение генов указывает на то, что эти кластеры генов развились в результате серии событий дупликации генов.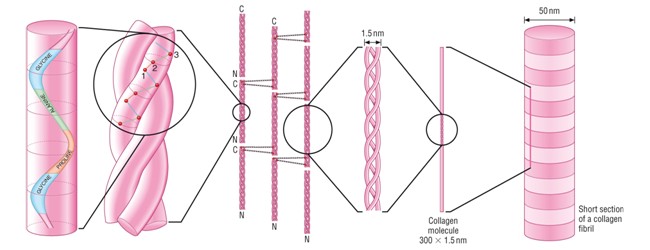
Определение последовательностей кератинов типа I и типа показало, что два типа кератинов имеют центральный сегмент длиной ~310 остатков, гомологичный примерно на 30%, но амино- и карбоксиконцевые области этих белков демонстрируют большое разнообразие [11] . В соответствии с первоначальными наблюдениями, секвенирование кератинов и др. белков промежуточных филаментов показало, что все белки IF имеют консервативный центральный домен и широко расходящиеся амино- и карбоксиконцевые области [13] .
Секвенирование и двухмерный гель-электрофорез всего семейства кератинов выявили, что кератины типа I и типа II различаются по размеру и изоэлектрическим точкам [14] [15] . Кератины типа I, как правило, меньше (средняя длина 460 а.о.) и кислые (изоэлектрическая точка 4,4-5,4), тогда как кератины типа II более длинные (средняя длина 545 а.о.) и основные (изоэлектрическая точка 5-8,3). Как уже отмечалось, различия в размерах кератинов являются результатом различий в амино- и карбоксиконцах белков 9.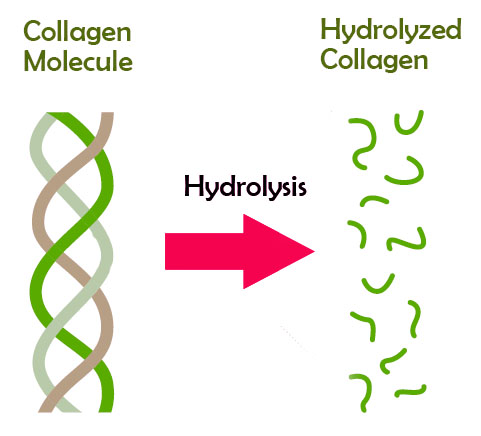 0011 [5] .
0011 [5] .
Вторичные структуры кератинов
Рис. 1. Расположение α-спиральных доменов (1А, 1В, 2А и 2В) в центральном стержне кератиновой субъединицы.
Первая модель альфа-спирали была предложена Полингом на основе кристаллографии шерстяных волокон [16] , которые показали наличие длинных спиральных сегментов [17] .
Анализ первой последовательности цитоскелетного кератина показал, что этот белок содержит центральный домен из ~310 остатков, который, как было предсказано, в основном находится в конформации α-спирали [11] . Путем сравнительного анализа предсказанных структур кератина типа I, кератина типа II, десмина и виментина Ханукоглу и Фукс предположили, что все белки IF имеют центральный домен ~310 остатков, который содержит четыре сегмента в α-спиральной конформации, которые разделены предсказано, что три коротких линкерных сегмента находятся в конформации бета-поворота [5] .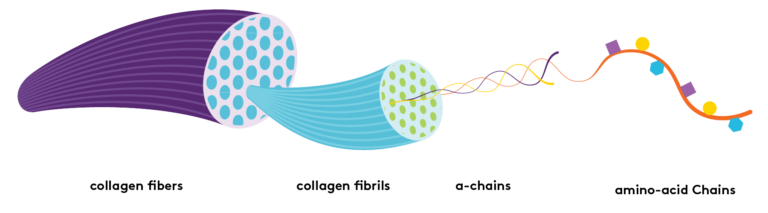 Эта модель была подтверждена анализом кристаллической структуры сегментов кератиновой спиральной катушки [18] .
Эта модель была подтверждена анализом кристаллической структуры сегментов кератиновой спиральной катушки [18] .
Структуры головного и хвостового доменов кератинов сильно различаются и не выяснены. Основываясь на их последовательностях, предполагается, что эти домены не являются спиральными, вероятно, образуя глобулярные структуры, которые участвуют во взаимодействиях между субъединицами и др. белками каркаса клеточного цитоскелета [14] .
Третичные и четвертичные структуры кератинов
Кератиновые волокна трудно растворяются, и до сих пор не удавалось кристаллизовать цельный кератин или комбинацию кератиновых полимеров. Перед лицом этой трудности растворимые сегменты кератинов были созданы как с помощью протеолитического расщепления, так и с помощью генной инженерии для изучения структурных свойств кератинов 9.0011 [19] .
Как отмечалось выше, кератиновые нити состоят из гетеродимеров. Чтобы экспрессировать длинный сегмент 2B гетеродимера кератинов K5 и K14, Lee et al. трансформировали две кДНК в E. coli, выделили гетеромерный комплекс и кристаллизовали его. Структурный анализ выявил спиральную спиральную гетеродимерную структуру K5 и K14, переплетенных друг вокруг друга. Эти данные показывают, что кератиновый филамент состоит из спирально-спирального гетеродимера, в котором сегменты 2В переплетаются параллельно 9.0011 [18] .
трансформировали две кДНК в E. coli, выделили гетеромерный комплекс и кристаллизовали его. Структурный анализ выявил спиральную спиральную гетеродимерную структуру K5 и K14, переплетенных друг вокруг друга. Эти данные показывают, что кератиновый филамент состоит из спирально-спирального гетеродимера, в котором сегменты 2В переплетаются параллельно 9.0011 [18] .
Все имеющиеся на сегодняшний день данные указывают на то, что основной единицей кератиновой нити является левосторонний гетеродимер согласованной пары кератинов, выстроенных параллельно. Кератиновая нить шириной ~10 нм собирается в несколько этапов [14] :
- Гетеро-димер: образован скручиванием подобранной пары кератинов типа I и типа II, которые образуют спиральную спираль.
- Тетрамер: Образуется путем связывания двух гетеродимеров в антипараллельной ориентации. Точное выравнивание белков, то есть, какие спиральные домены лежат бок о бок, неизвестно.
- Октамер: образован параллельным связыванием двух тетрамеров, содержащих в общей сложности восемь молекул кератина.
 Такой октамер называется протофибриллой .
Такой октамер называется протофибриллой . - Филаменты единичной длины (ULF): образованы латеральной — бок о бок — ассоциацией четырех протофибрилл. На поперечном сечении протофибрилла имеет 32 кератиновые цепи. ULF имеют длину ~ 60 нм и ширину ~ 20 нм.
- Кератиновая нить: образована сквозной ассоциацией ULF. После сборки филамент уплотняется до ширины 10-12 нм.
Таким образом, в общей картине спиральные домены кератинов образуют костяк филаментов, а головной и хвостовой домены участвуют в связывании белков «конец в конец».
Рис. кератин К5 типа II (цепь В) (остатки Ser332-Gly421 К14 и Thr382-Gly476 К5). Идентификатор PDB: 3tnu. Щелкните ссылки зеленого цвета в тексте, чтобы просмотреть выделенные элементы конструкции.
Основной структурной единицей кератиновых нитей является гетеродимер кератина типа I и типа II.
Кристаллическая структура спиральных доменов 2B кератинов K5 и K14, состоящих из спиральных клубков, выявила связи, участвующие в прочном связывании двух субъединиц [18] .
Прежде чем перечислять связи, участвующие в связывании кератина с кератином, необходимо понять структуру α-спирали. Остов α-спирали состоит из атомов, участвующих в образовании пептидных связей, соединяющих аминокислотные остатки. Структуру спирали можно представить себе как цилиндр, вокруг которого намотана цепочка остатков. Центральная ось этого цилиндра определяет центральную ось спирали. R-группы остатков расположены перпендикулярно центральной оси. Таким образом, винтовая поверхность покрыта R-группами, выступающими наружу от центральной оси спирали.
Связывание двух спиральных доменов в переплетенной структуре требует, чтобы поверхности спиральных доменов содержали атомы или группы, которые участвуют в связывании двух цепей.
Белковые цепи могут связываться друг с другом несколькими типами связей:
- Ковалентные связи. Пример: дисульфидная связь S-S между двумя цистеинами.
- Ионные связи между заряженными остатками с дополнительным зарядом.
 Пример: Glu-Arg.
Пример: Glu-Arg.
- Гидрофобные взаимодействия между гидрофобными остатками. Пример: Леу-Вал.
- Водородные связи между подходящими группами.
В доменах 2B кератинов типа I K14 и типа II K5, показанных на рис. 2, имеется два и один цистеин соответственно. Эти цистеины расположены далеко друг от друга и не могут образовывать дисульфидные мостики.
- (Подождите несколько секунд для смены сцены)
Таким образом, дисульфидные мостики не могут быть ответственны за связывание K14 и K5.
Второй вариант – это ионные связи или солевые мостики между двумя кератинами.
Видно, что как кислотные, так и основные остатки выступают в основном к внешней поверхности двух кератинов и едва ли в пространстве между двумя кератинами. Контактная поверхность между двумя кератинами в скрученной катушке расположена между двумя кератинами. Таким образом, заряженные остатки не играют преобладающей роли в образовании спиральной катушки.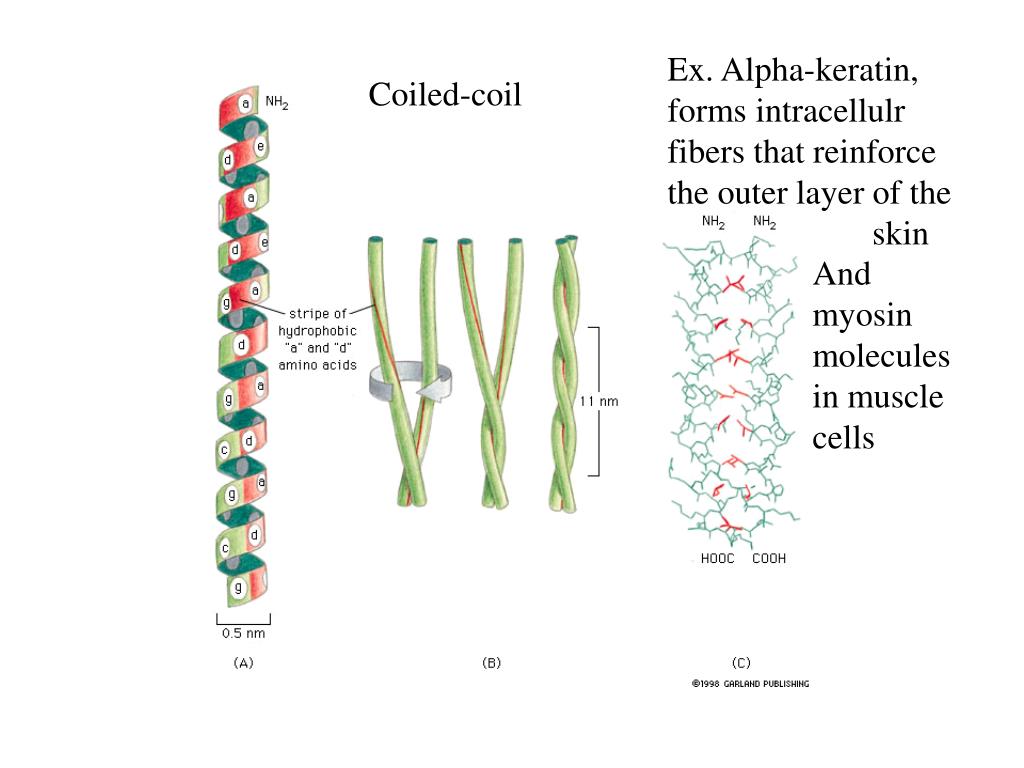 В димере К14-К5 только 3-4 остатка участвуют в межцепочечных взаимодействиях. Тем не менее, эти остатки необходимы для нормальной функции кератина 9.0011 [18] .
В димере К14-К5 только 3-4 остатка участвуют в межцепочечных взаимодействиях. Тем не менее, эти остатки необходимы для нормальной функции кератина 9.0011 [18] .
Гидрофобные остатки: основные точки контакта между цепями
Третий вариант, упомянутый выше, — это гидрофобные взаимодействия между двумя кератинами.
Видно, что гидрофобные остатки располагаются преимущественно на границе раздела двух цепей и в основном занимают пространство между этими цепями. Таким образом, гидрофобные остатки, которые могут ассоциироваться друг с другом в водной среде клетки, являются основными точками контакта между цепями в суперспирале.
Поскольку две цепи кератинов переплетаются параллельно, точки контакта вдоль всей спиральной катушки представляют собой шов вдоль двух белков. Спиралевидные структуры обнаружены во многих типах белков. В двухцепочечных спиральных белках гидрофобные остатки появляются в виде периодического паттерна, который был назван heptad-repeat [20] . В правильной α-спирали на один оборот спирали приходится 3,6 остатка. В левосторонней спиральной обмотке на виток приходится 3,5 остатка. Таким образом, в двухцепочечной скрученной спирали есть повторяющийся образец из семи остатков, которые представлены буквами a-b-c-d-e-f-g. Остатки a и d в этой схеме являются гидрофобными. Эти два остатка определяют гидрофобный фланг для каждого белка. Этот периодический паттерн был впервые описан для кератинов шерсти как типа I, так и типа II 9.0011 [21] , а позже наблюдались на кератинах цитоскелета, а также [5] . Кристаллические структуры сегмента 2B кератинов K14 и K5 обеспечили окончательное подтверждение роли этих гидрофобных остатков в образовании спиральных спиралей [18] .
В правильной α-спирали на один оборот спирали приходится 3,6 остатка. В левосторонней спиральной обмотке на виток приходится 3,5 остатка. Таким образом, в двухцепочечной скрученной спирали есть повторяющийся образец из семи остатков, которые представлены буквами a-b-c-d-e-f-g. Остатки a и d в этой схеме являются гидрофобными. Эти два остатка определяют гидрофобный фланг для каждого белка. Этот периодический паттерн был впервые описан для кератинов шерсти как типа I, так и типа II 9.0011 [21] , а позже наблюдались на кератинах цитоскелета, а также [5] . Кристаллические структуры сегмента 2B кератинов K14 и K5 обеспечили окончательное подтверждение роли этих гидрофобных остатков в образовании спиральных спиралей [18] .
Трехмерная структура кератина
Обновлено 12 октября 2021 г.
4zry, 6e2j, 6uui – спираль 2B домена hKRT1 + домен катушки 2B hKRT10 – человек0280 6ec0 – hKRT1 спиральный домен 1B + hKRT10 спиральный домен 1B
3tnu — остатки hKRT14 295-422 + остатки hKRT5 350-477
6jfv — остатки hKRT14 327-421 (мутант) + остатки пептида hKRT5 379-476 10f,
1zw, hKRT5 3asw + коэффициент слипания B
Ссылки
- ↑ Ханукоглу И.
 , Эзра Л. Запись в Протеопедии: спирально-спиральная структура кератинов. Biochem Mol Biol Educ. 2014 янв-февраль;42(1):93-4. doi: 10.1002/bmb.20746. Epub 2013, 22 ноября. PMID: 24265184 doi: http://dx.doi.org/10.1002/bmb.20746
, Эзра Л. Запись в Протеопедии: спирально-спиральная структура кератинов. Biochem Mol Biol Educ. 2014 янв-февраль;42(1):93-4. doi: 10.1002/bmb.20746. Epub 2013, 22 ноября. PMID: 24265184 doi: http://dx.doi.org/10.1002/bmb.20746 - ↑ Молл Р., Диво М., Лангбейн Л. Кератины человека: биология и патология. Гистохим клеточной биологии. 2008 г., июнь; 129 (6): 705-33. doi: 10.1007/s00418-008-0435-6. Epub, 7 мая 2008 г. PMID:18461349 doi:10.1007/s00418-008-0435-6
- ↑ 3.0 3.1 3.2 3.3 Годсел Л.М., Хоббс Р.П., Грин К.Дж. Сборка промежуточных филаментов: динамика болезни. Тенденции клеточной биологии. 2008 Январь; 18 (1): 28-37. PMID:18083519 doi:10.1016/j.tcb.2007.11.004
- ↑ Эрикссон Дж.Э., Дечат Т., Грин Б., Хельфанд Б., Мендес М., Паллари Х.М., Голдман Р.Д. Внедрение промежуточных филаментов: от открытия к болезни. Джей Клин Инвест. 2009 г.Июль; 119 (7): 1763-71. DOI: 10.1172/JCI38339. Epub 2009, 1 июля. PMID: 19587451 doi: 10.
 1172/JCI38339
1172/JCI38339 - ↑ 5,0 5.1 5,2 5,3 5,4 5,5 5,6 Hanukoglu I, Fuchs E. Последовательность кДНК цитоскелетной контейнеры и визуальных конструктивных конструктив. Клетка. 1983 г., июль; 33 (3): 915-24. PMID:6191871
- ↑ Фукс Э. Цитоскелет и болезни: генетические нарушения промежуточных филаментов. Анну Рев Жене. 1996;30:197-231. PMID:8982454 doi:10.1146/annurev.genet.30.1.197
- ↑ Suozzi KC, Wu X, Fuchs E. Spectraplakins: главные организаторы динамики цитоскелета. Джей Селл Биол. 2012 14 мая; 197 (4): 465-75. doi: 10.1083/jcb.201112034. PMID:22584905 doi:10.1083/jcb.201112034
- ↑ Уэйд Р.Х. На микротрубочках и вокруг них: обзор. Мол Биотехнолог. 2009 г., октябрь; 43 (2): 177–91. doi: 10.1007/s12033-009-9193-5. Epub 2009, 30 июня. PMID:19565362 doi:10.1007/s12033-009-9193-5
- ↑ Schweizer J, Bowden PE, Coulombe PA, Langbein L, Lane EB, Magin TM, Maltais L, Omary MB, Parry DA, Rogers MA, Wright MW.
 Новая согласованная номенклатура кератинов млекопитающих. Джей Селл Биол. 2006 17 июля; 174 (2): 169-74. Epub 2006, 10 июля. PMID: 16831889 doi: 10.1083/jcb.200603161
Новая согласованная номенклатура кератинов млекопитающих. Джей Селл Биол. 2006 17 июля; 174 (2): 169-74. Epub 2006, 10 июля. PMID: 16831889 doi: 10.1083/jcb.200603161 - ↑ 10.0 10.1 Гессе М., Зимек А., Вебер К., Магин Т.М. Комплексный анализ кластеров генов кератина у человека и грызунов. Eur J Cell Biol. 2004 г., февраль; 83 (1): 19–26. PMID: 15085952
- ↑ 11,0 11,1 11,2 Ханукоглу I, Фукс Э. Последовательность кДНК эпидермального кератина человека: расхождение последовательности, но сохранение структуры среди белков промежуточных филаментов. Клетка. 1982 ноября; 31(1):243-52. PMID:6186381
- ↑ Schweizer J, Langbein L, Rogers MA, Winter H. Кератины, специфичные для волосяных фолликулов, и их заболевания. Разрешение ячейки опыта. 2007 10 июня; 313(10):2010-20. Epub 2007, 14 марта. PMID:17428470 doi:10.1016/j.yexcr.2007.02.032
- ↑ Парри Д.А., Стрелков С.В., Буркхард П., Эби У., Херрманн Х.
 К молекулярному описанию структуры и сборки промежуточных филаментов. Разрешение ячейки опыта. 2007 10 июня; 313 (10): 2204-16. Epub 2007, 12 апреля. PMID: 17521629 doi: 10.1016 / j.yexcr.2007.04.009
К молекулярному описанию структуры и сборки промежуточных филаментов. Разрешение ячейки опыта. 2007 10 июня; 313 (10): 2204-16. Epub 2007, 12 апреля. PMID: 17521629 doi: 10.1016 / j.yexcr.2007.04.009 - ↑ 14,0 14,1 14,2 Брагулла Х.Х., Хомбергер Д.Г. Структура и функции белков кератина в простых, многослойных, ороговевающих и ороговевших эпителиях. Дж Анат. 2009 апрель; 214(4):516-59. PMID: 19422428 дои: JOA1066
- ↑ Молл Р., Диво М., Лангбейн Л. Кератины человека: биология и патология. Гистохим клеточной биологии. 2008 г., июнь; 129 (6): 705-33. doi: 10.1007/s00418-008-0435-6. Epub, 7 мая 2008 г. PMID:18461349 doi:10.1007/s00418-008-0435-6
- ↑ Эйзенберг Д. Открытие альфа-спирали и бета-листа, основных структурных особенностей белков. Proc Natl Acad Sci USA. 30 сентября 2003 г .; 100 (20): 11207-10. Epub 2003 9 сентября. PMID: 12966187 doi: http://dx.doi.org/10.1073/pnas.2034522100
- ↑ Crewther WG, Harrap BS. Получение и свойства спиралевидной фракции, полученной путем частичного протеолиза низкосернистого S-карбоксиметилкератина из шерсти.
 Дж. Биол. Хим. 1967 10 октября; 242 (19): 4310-9. PMID:6072928
Дж. Биол. Хим. 1967 10 октября; 242 (19): 4310-9. PMID:6072928 - ↑ 18.0 18.1 18.2 18.3 18.4 Lee CH, Kim MS, Chung BM, Leahy DJ, Coulombe PA. Структурная основа гетеромерной сборки и перинуклеарной организации кератиновых филаментов. Nat Struct Mol Biol. 2012 17 июня; 19(7): 707-15. doi: 10.1038/nsmb.2330. PMID:22705788 doi:10.1038/nsmb.2330
- ↑ Парри Д.А., Стрелков С.В., Буркхард П., Эби У., Херрманн Х. К молекулярному описанию структуры и сборки промежуточных филаментов. Разрешение ячейки опыта. 2007 10 июня; 313 (10): 2204-16. Epub 2007, 12 апреля. PMID:17521629 doi:10.1016/j.yexcr.2007.04.009
- ↑ Вулфсон Д.Н. Проектирование спирально-витковых конструкций и агрегатов. Adv Protein Chem. 2005;70:79-112. PMID: 15837514 doi: 10.1016/S0065-3233(05)70004-8
- ↑ Elleman TC, Crewther WG, Van Der Touw J. Аминокислотные последовательности альфа-спиральных сегментов S-карбоксиметилкератеина-A.
 Статистический анализ. Biochem J. 1978 Aug 1;173(2):387-91. PMID:697726
Статистический анализ. Biochem J. 1978 Aug 1;173(2):387-91. PMID:697726
Страница Proteopedia Авторы и редакторы
(что это?)
Исраэль Ханукоглу, Михал Харел, Лиора Эзра, Анхель Эрраез
Конституция молекулы кератина
- Опубликовано:
- J. B. SPEAKMAN 1 и
- MERCIA C. HIRST 1
Природа
том 129 , страницы 938–939 (1932 г.)Процитировать эту статью
21 доступ
1 Цитаты
Детали показателей
Abstract
Из двух комментариев, которые д-р Римингтон 1 должен сделать к нашей недавней заметке 2 относительно строения молекулы кератина, один ошибочен, а другой вводит в заблуждение.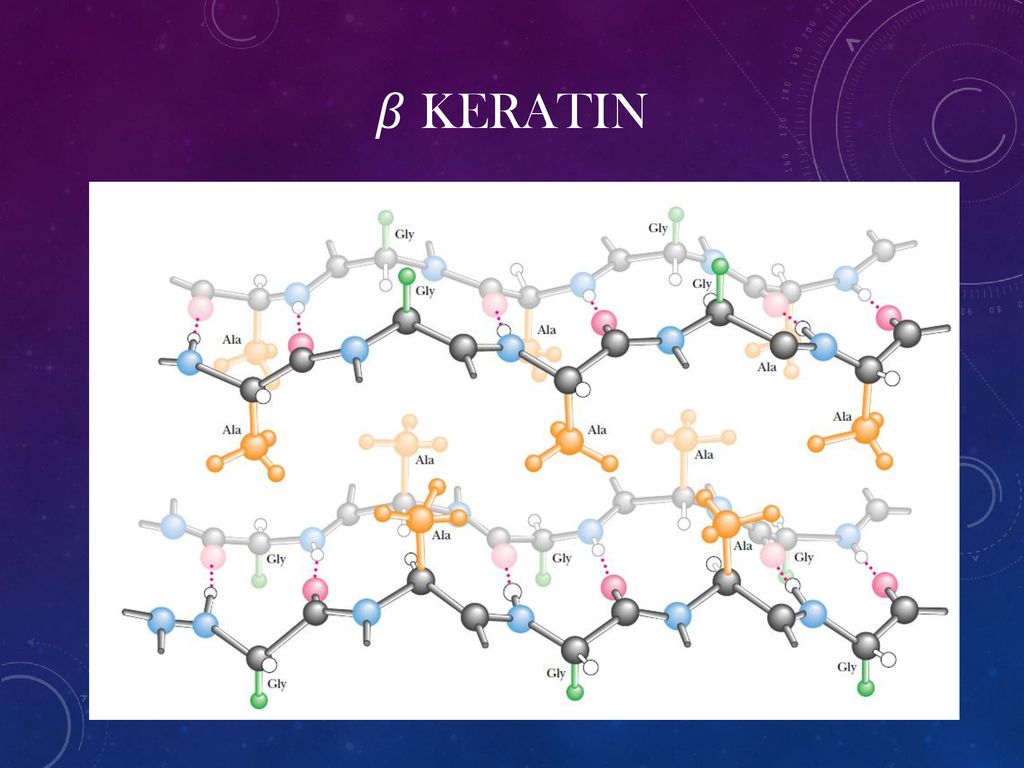 В нашем первоначальном сообщении мы утверждаем, что показали, что количество свободного аминного азота в шерсти точно эквивалентно количеству соляной кислоты, абсорбированной из раствора при p H 1,0 и к содержанию аргинина и лизина в волокне, как определено Марстоном. 3 По мнению Римингтона, значение этих тождеств теряется, поскольку «гуанидиновая группа аргинина не дает азота с азотистой кислотой в обычных условиях». Ван Слайк и Берчард 4 цитируются в поддержку этого утверждения, а более поздняя статья Плиммера 5 игнорируется. Последнее показало, что гуанидиновая группа аргинина медленно атакует азотистой кислотой в обычных условиях, и его данные показывают, что за двадцать четыре часа реакция со второй аминогруппой почти завершена. Все определения свободного аминного азота в шерсти, которые мы произвели, проводились в течение суток, и, следовательно, нет необходимости следовать Римингтону в его предположении, что «шерсть, вероятно, содержит гидроксилизин или другую диаминокислоту вдобавок к ней».
В нашем первоначальном сообщении мы утверждаем, что показали, что количество свободного аминного азота в шерсти точно эквивалентно количеству соляной кислоты, абсорбированной из раствора при p H 1,0 и к содержанию аргинина и лизина в волокне, как определено Марстоном. 3 По мнению Римингтона, значение этих тождеств теряется, поскольку «гуанидиновая группа аргинина не дает азота с азотистой кислотой в обычных условиях». Ван Слайк и Берчард 4 цитируются в поддержку этого утверждения, а более поздняя статья Плиммера 5 игнорируется. Последнее показало, что гуанидиновая группа аргинина медленно атакует азотистой кислотой в обычных условиях, и его данные показывают, что за двадцать четыре часа реакция со второй аминогруппой почти завершена. Все определения свободного аминного азота в шерсти, которые мы произвели, проводились в течение суток, и, следовательно, нет необходимости следовать Римингтону в его предположении, что «шерсть, вероятно, содержит гидроксилизин или другую диаминокислоту вдобавок к ней». к лизину». «Другая диаминокислота», несомненно, аргинин.
к лизину». «Другая диаминокислота», несомненно, аргинин.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Варианты доступа
Подписка на этот журнал
Получите 51 печатный выпуск и онлайн-доступ
199,00 € в год
всего 3,90 € за выпуск
Подробнее
Арендуйте или купите этот товар
Получите только этот товар столько, сколько вам нужно
$39,95
Узнайте больше
Цены могут облагаться местными налогами, которые рассчитываются при оформлении заказа
Каталожные номера
Римингтон, NATURE , 129 , 580; 16 апреля 1932 г.
Статья
КАС
ОБЪЯВЛЕНИЯGoogle Scholar
Спикер, ПРИРОДА , 128 , 1073; 26 декабря 1931 г.
Статья
ОБЪЯВЛЕНИЯGoogle Scholar
Марстон, Совет ученых.
 и Ind. Research, Австралийское Содружество, Бык. 38; 1928.
и Ind. Research, Австралийское Содружество, Бык. 38; 1928.Van Slyke and Bichard, J. Biol. хим. , 16 , 539; 1913–14.
Google Scholar
Пламмер, Биохим. Дж. , 18 , 105; 1924.
Артикул
КАСGoogle Scholar
Vickery and Block, J. Biol. хим. , 86 , 107; 1930.
КАС
Google Scholar
Vickery and Leavenworth, J. Biol. хим. , 83 , 523; 1929.
КАС
Google Scholar
Abderhalden and Voitinovici, Z. physiol. хим. , 52 , 368; 1907.
Артикул
Google Scholar
Скачать ссылки
Информация о авторе
Авторы и принадлежность
Лаборатория текстильной химии, Университет, Leeds
J.

 1 Гидрофобные остатки: основные точки контакта между цепями
1 Гидрофобные остатки: основные точки контакта между цепями Такой октамер называется протофибриллой .
Такой октамер называется протофибриллой . Пример: Glu-Arg.
Пример: Glu-Arg. , Эзра Л. Запись в Протеопедии: спирально-спиральная структура кератинов. Biochem Mol Biol Educ. 2014 янв-февраль;42(1):93-4. doi: 10.1002/bmb.20746. Epub 2013, 22 ноября. PMID: 24265184 doi: http://dx.doi.org/10.1002/bmb.20746
, Эзра Л. Запись в Протеопедии: спирально-спиральная структура кератинов. Biochem Mol Biol Educ. 2014 янв-февраль;42(1):93-4. doi: 10.1002/bmb.20746. Epub 2013, 22 ноября. PMID: 24265184 doi: http://dx.doi.org/10.1002/bmb.20746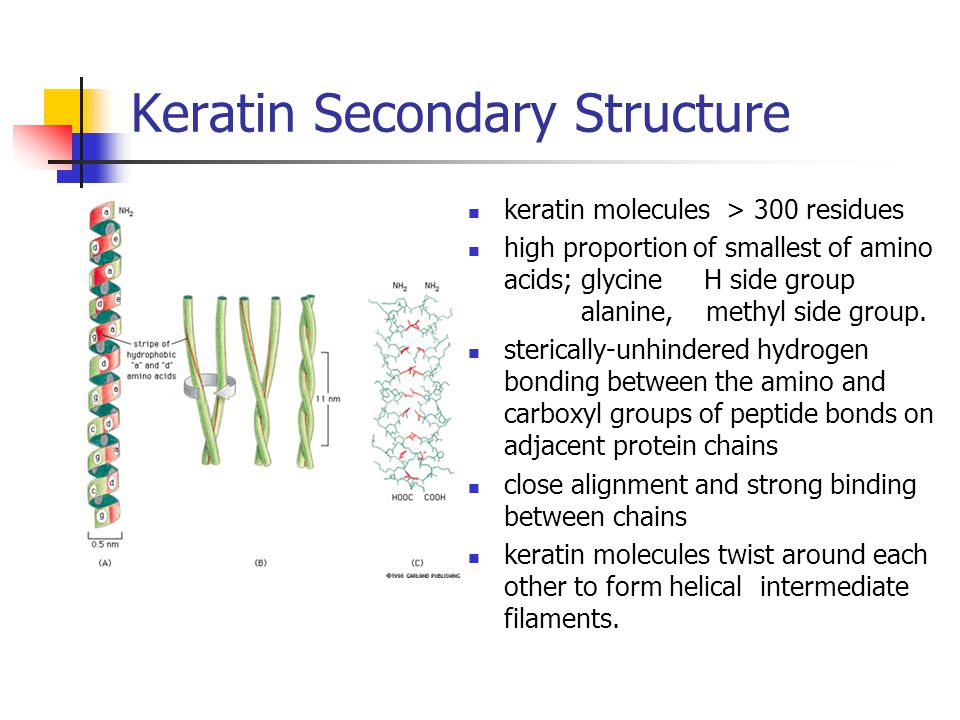 1172/JCI38339
1172/JCI38339 Новая согласованная номенклатура кератинов млекопитающих. Джей Селл Биол. 2006 17 июля; 174 (2): 169-74. Epub 2006, 10 июля. PMID: 16831889 doi: 10.1083/jcb.200603161
Новая согласованная номенклатура кератинов млекопитающих. Джей Селл Биол. 2006 17 июля; 174 (2): 169-74. Epub 2006, 10 июля. PMID: 16831889 doi: 10.1083/jcb.200603161 К молекулярному описанию структуры и сборки промежуточных филаментов. Разрешение ячейки опыта. 2007 10 июня; 313 (10): 2204-16. Epub 2007, 12 апреля. PMID: 17521629 doi: 10.1016 / j.yexcr.2007.04.009
К молекулярному описанию структуры и сборки промежуточных филаментов. Разрешение ячейки опыта. 2007 10 июня; 313 (10): 2204-16. Epub 2007, 12 апреля. PMID: 17521629 doi: 10.1016 / j.yexcr.2007.04.009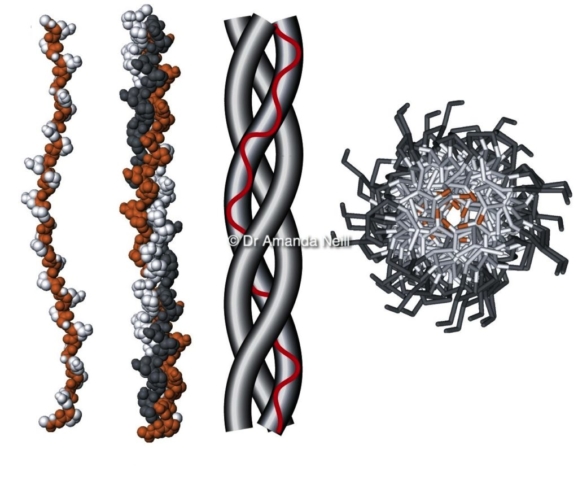 Дж. Биол. Хим. 1967 10 октября; 242 (19): 4310-9. PMID:6072928
Дж. Биол. Хим. 1967 10 октября; 242 (19): 4310-9. PMID:6072928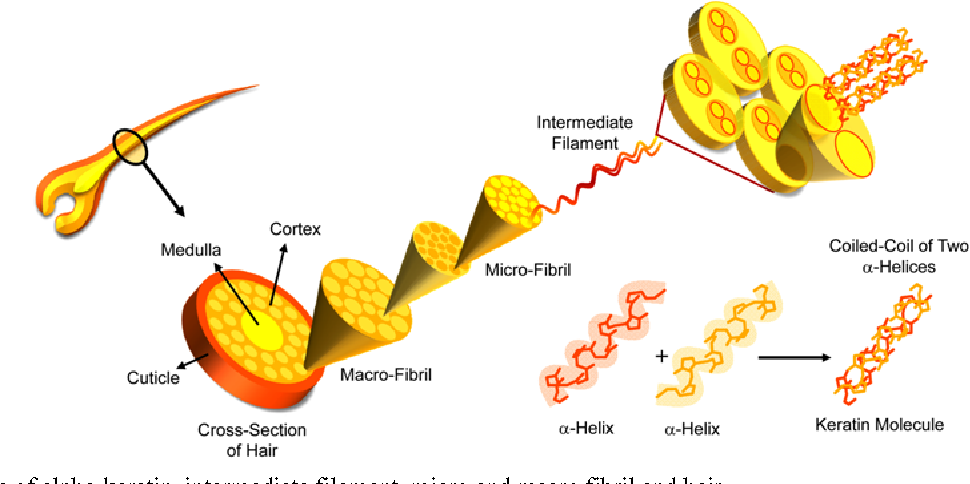 Статистический анализ. Biochem J. 1978 Aug 1;173(2):387-91. PMID:697726
Статистический анализ. Biochem J. 1978 Aug 1;173(2):387-91. PMID:697726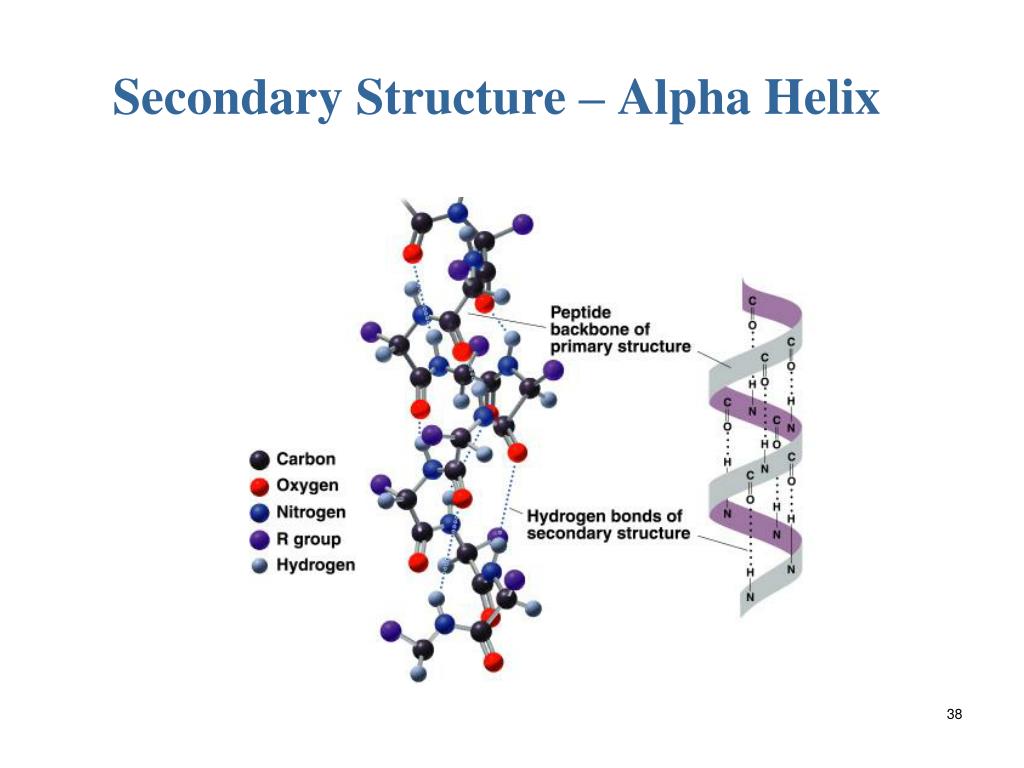 и Ind. Research, Австралийское Содружество, Бык. 38; 1928.
и Ind. Research, Австралийское Содружество, Бык. 38; 1928.