Теломеры: что это и как они влияют на старение
Наши хромосомы укорачиваются с возрастом. Рассказываем, как это происходит, при чем здесь теломеры и как их длина связана с продолжительностью жизни
Содержание
- Что это
- Что происходит с ними с возрастом
- Что их укорачивает
- Что поддерживает их длину
- Как измерить их длину
- Теломеры и рак
- Перспективы человеческого бессмертия
Что такое теломеры
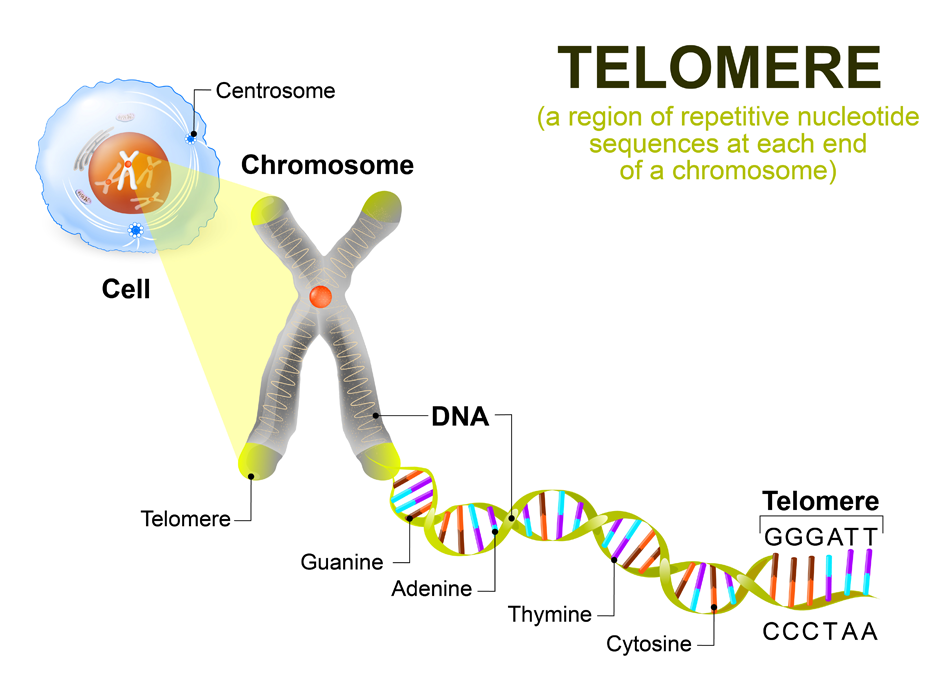
Теломеры — это области на концах хромосомы, которые защищают ее от повреждений и «склеивания» с другими хромосомами. Иногда теломеры называют «защитными колпачками» хромосомы.
Теломеры видимы в световой микроскоп: их можно окрасить таким образом, чтобы они отличались по цвету от центральных частей каждой хромосомы. Световые пятна на фото — это и есть теломеры на концах хромосом.
(Фото: commons. wikimedia.org)
wikimedia.org)
Изучение теломер началось в 1930-е годы. Американский генетик Герман Меллер (Hermann Joseph Muller) проводил эксперименты с плодовыми мухами. Он использовал рентгеновские лучи, чтобы заставить хромосомы мушек изменять свою структуру — мутировать, и с удивлением заметил, что кончики хромосом были устойчивы к действию лучей. Меллер предположил, что эти кончики выполняют какую-то особую функцию — как-то «запечатывают» хромосому, не давая ей изменяться. Меллер назвал эти концы теломерами (от греческих слов telo, что означает «конец», и mere — «часть») [1].
Сегодня ученые знают, что теломеры действительно играют важную роль в стабилизации формы хромосом. Они не дают хромосомам «срастаться» друг с другом. Объясняя защитную функцию теломер, цитогенетик Элизабет Блэкберн (Elizabeth Blackburn) сравнивает их с пластиковыми наконечниками шнурков, которые предохраняют сами шнурки (то есть хромосомы) от распутывания [2].
Период активного изучения теломер пришелся на 80-е годы и продолжился вплоть до 2000-х годов. В 2009 году Нобелевская премия по медицине была присуждена Элизабет Блэкберн, Кэрол Грейдер (Carol Greider) и Джеку Шостаку (Jack Szostak) «за открытие того, как теломеры и связанный с ними фермент теломераза защищают хромосомы» [3].
В 2009 году Нобелевская премия по медицине была присуждена Элизабет Блэкберн, Кэрол Грейдер (Carol Greider) и Джеку Шостаку (Jack Szostak) «за открытие того, как теломеры и связанный с ними фермент теломераза защищают хромосомы» [3].
Современные исследования теломер продолжаются. Одно из перспективных направлений — связь теломер и человеческого старения. Об этой взаимосвязи ученые высказываются с осторожностью: пока нет стопроцентных доказательств того, что, влияя на теломеры, мы непременно увеличим свою продолжительность жизни. Но идея изобрести с помощью теломер лекарство от старости кажется ученым невероятно привлекательной. Сторонники теломерной теории старения уверены, что именно теломеры помогут нам провести жизнь более здоровыми и активными [4].
Что происходит с теломерами с возрастом
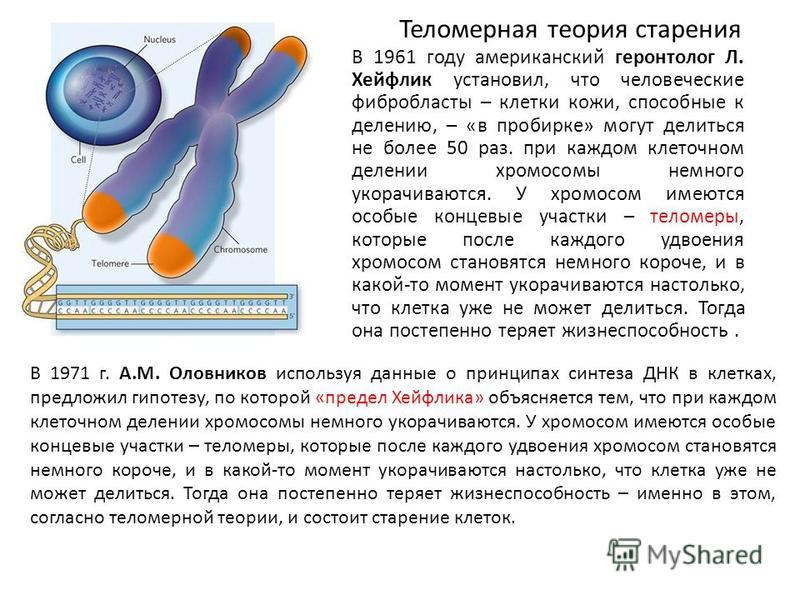
В 1961 году профессор анатомии Леонард Хейфлик (Leonard Hayflick) из Калифорнийского университета обнаружил, что клетки человека делятся ограниченное число раз и умирают приблизительно после 50 делений. Этот порог в 50 делений назвали пределом Хейфлика. И именно теломеры «отмеряли», сколько еще раз могла делиться клетка.
Этот порог в 50 делений назвали пределом Хейфлика. И именно теломеры «отмеряли», сколько еще раз могла делиться клетка.
Большинство человеческих клеток делится от 40 до 60 раз , прежде чем умереть. По мере деления клетки теломеры на конце хромосомы становятся меньше, а к концу жизненного цикла клетки почти исчезают [5].
(Фото: commons.wikimedia.org)
В стареющем организме деление происходит все реже и реже. Когда после определенного числа делений теломеры исчезают совсем, клетка запускает программу разрушения.
Так выглядит апоптоз — запрограммированная гибель клетки, которая после примерно 50 делений распадается на отдельные фрагменты и в итоге исчезает.
(Фото: biomolecula. ru)
ru)
Исследования показывают, что старение организма связано с укорачиванием теломер, но не сводится к нему [6]. Старые клетки есть и в молодом организме. Разница в том, что с возрастом их становится все больше: накопление старых клеток приводит к дегенеративным процессам, которые, в свою очередь, приводят к возрастным заболеваниям.
Врач превентивной медицины и наставник по здоровью сервиса Health Buddy Елена Агапова подтверждает, что одним из факторов, влияющих на скорость старения и продолжительность жизни, является длина теломер. Этот фактор не определяющий. Старение связано с другими процессами — избытком свободных радикалов в клетках организма, сахаростарением и, конечно, с хронологическим, то есть паспортным возрастом каждого из нас.
Тем не менее, не всегда дата рождения в паспорте указывает на реальное состояние организма. Например, вам может быть 45 лет, но чувствовать вы себя будете как шестидесятилетний. В медицине существует понятие «биологический возраст», он показывает, насколько активны процессы клеточного старения. И возможно, что именно длина теломер представляет наш биологический возраст.
И возможно, что именно длина теломер представляет наш биологический возраст.
Врач-кардиолог, доктор медицинских наук Татьяна Бродовская поясняет, что сокращение длины теломер связано с болезнью Альцгеймера, высоким кровяным давлением, диабетом 2-го типа, атеросклерозом. Все эти заболевания считаются возрастными, то есть между короткими теломерами и старением есть связь. Но пока неизвестно, короткие теломеры — это признак старения, как седые волосы, или это одна из его причин.
У некоторых долгоживущих видов, таких как люди, теломеры намного короче, чем, например, у мышей, которые живут всего несколько лет. Пока неизвестно, почему так происходит, но это свидетельствует о том, что сами по себе теломеры не определяют продолжительность жизни. Старение — это многофакторный процесс, и длина теломер — лишь один из его механизмов.
Что укорачивает теломеры
У разных людей теломеры становятся короче с разной скоростью. Ученые исследовали некоторые факторы, которые приводят к более быстрому, чем обычно, укорачиванию теломер и, вероятно, к преждевременному старению.
Длительный психологический стресс
Некоторые исследования указывают, что стресс связан с клеточным старением и, возможно, ускоряет его [7]. Элизабет Блэкберн рассказывает, что ее лаборатория изучала матерей хронически больных детей, а также женщин после 45 лет, которые ухаживали за больным членом семьи. В обеих группах, чем сильнее был стресс от забот и чем дольше его испытывали женщины, тем больше «истощались» их теломеры [8].
Проблемы с сердцем и сосудами
В этом же исследовании Блэкберн обнаружила связь между стрессом, болезнями сердца и короткими теломерами. Ученые проанализировали показатели сердечно-сосудистых заболеваний: уровень холестерина, ожирения и некоторые другие. У женщин с плохими показателями были короткие теломеры [9].
Воздействие вредных веществ
Тяжелые металлы, например кадмий, значительно укорачивают теломеры. Токсичные вещества провоцируют сердечно-сосудистые заболевания, респираторные нарушения, рак. Ученый, проводивший масштабное исследование воздействия тяжелых металлов на человека, отмечает, что люди подвергаются токсичному воздействию, когда едят фрукты и овощи, выращенные на загрязненной почве, живут вблизи промышленных объектов или вдыхают табачный дым [10].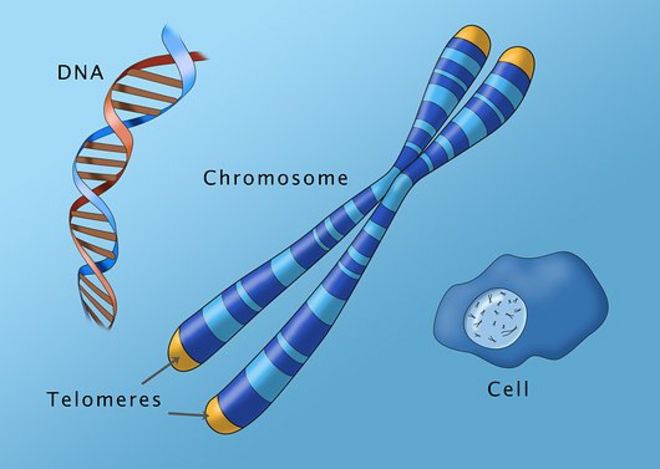
Связь между курением и укороченными теломерами подтверждается и другими исследованиями. Их общий вывод — у курильщиков действительно более короткие теломеры по сравнению с теми, кто никогда не курил. Вредные вещества из табачного дыма ускоряют развитие возрастных заболеваний и укорачивают теломеры. Для некурящих людей самый распространенный источник токсического воздействия тяжелых металлов — это продукты питания [11].
Избыточный вес
Ученые выдвинули гипотезу, что избыточный вес как фактор преждевременного старения может влиять и на длину теломер. Некоторые исследования ее подтверждают: заметное укорочение теломер было обнаружено у женщин с избыточным весом или ожирением в промежутке от 30 до 39 лет. Вывод — ожирение может ускорять старение, и в зрелом возрасте важно поддерживать оптимальный вес. Кроме того, длительное ожирение может быть более опасным — у женщин, у которых уже был избыточный вес на момент 30 лет, теломеры были короче, чем у тех, кто прибавил в весе уже после 30 [12].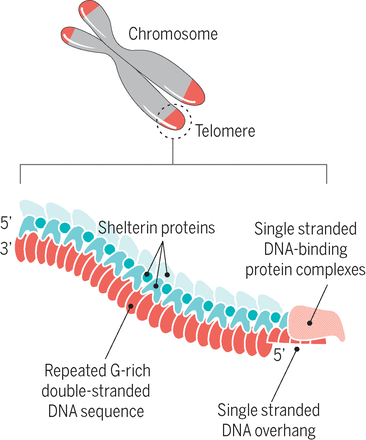
Ученые напоминают, что длина теломер так или иначе изменится с возрастом. Но именно ускоренное уменьшение теломер приводит к преждевременному старению, апоптозу или злокачественному изменению клеток, негативно влияя на здоровье и продолжительность жизни человека [13].
Что поддерживает длину теломер
Это делает теломераза — особое сочетание белка и РНК (рибонуклеиновой кислоты), которое вырабатывается в самой клетке. Основная задача теломеразы — поддерживать длину теломер. Она в буквальном смысле удлиняет концы хромосом [14].
На рисунке показан упрощенный процесс того, как «головастик»-теломераза удлиянет «ленточку»-кончик хромосомы — теломеру. С помощью компонентов теломеразы теломеры «достраиваются» до нужной длины.
(Фото: longlonglife.org)
Ученые давно изучают факторы, помогающие работе теломеразы и замедляющие укорачивание теломер. Элизабет Блэкберн называет некоторые из них — спорт, интересное хобби и отсутствие хронического стресса. Она объясняет, что у каждого из нас есть свой «срок здоровья» — количество лет, в течение которых мы остаемся здоровыми и активными, пока теломеры достаточно длинные. Но и мы сами способны повлиять на теломеразу и теломеры и отсрочить переход от здоровья к болезням. Генетик подчеркивает, что речь идет не об экстремальном увеличении жизни, а именно об активном долголетии [15].
Элизабет Блэкберн называет некоторые из них — спорт, интересное хобби и отсутствие хронического стресса. Она объясняет, что у каждого из нас есть свой «срок здоровья» — количество лет, в течение которых мы остаемся здоровыми и активными, пока теломеры достаточно длинные. Но и мы сами способны повлиять на теломеразу и теломеры и отсрочить переход от здоровья к болезням. Генетик подчеркивает, что речь идет не об экстремальном увеличении жизни, а именно об активном долголетии [15].
Физическая нагрузка
По словам Блэкберн, для сохранения здоровья не нужно истязать себя в спортзале по три часа в день или бегать по марафону в неделю. Люди, которые занимаются умеренными аэробными упражнениями — примерно три раза в неделю по 45 минут — имеют теломеры почти такой же длины, как и марафонцы.
Заниматься разными видами спорта полезнее, чем каким-то одним. Есть данные, что чем больше разных упражнений выполняли люди, тем длиннее были их теломеры. Даже 10–15 минут легких физических упражнений в день сглаживают эффект хронического стресса, вызванного, например, сидячим образом жизни [16].
Умеренное и сбалансированное питание
Есть данные, что употребление в пищу клетчатки и снижение количества белка увеличивает продолжительность жизни. Диета с ограничением белка в пище на 40% привела к увеличению продолжительности жизни крыс на 15%, что сопровождалось значительно более длинными теломерами в почках [17]. Несмотря на то, что эксперименты проводились с крысами, ученые видят здесь взаимосвязь с низкобелковой и высокоуглеводной диетой японцев, нации с самой высокой продолжительностью жизни [18]
Кроме того, некоторые исследования указывают на взаимосвязь между рационом беременной женщины и длиной теломер ее ребенка во взрослом возрасте. Например, обнаружилась зависимость между потреблением кофеина матерью во время беременности и более длинными теломерами ее ребенка. Тем не менее, ученые отмечают, что связи между питанием и теломерами еще недостаточно изучены, и не делают категоричных выводов [19], [20].
Майер-терапевт, врач клиники превентивной и антиэйдж-медицины Verba Mayr Инна Решетова считает, что кратковременное голодание — один из самых действенных способов поддержать здоровье./13_m3.jpg) Оно влияет сразу на все механизмы старения, в том числе на длину теломер путем активации теломеразы. Люди, которые голодают хотя бы раз в неделю или делают промежутки между приемами пищи около 16–18 часов (интервальный голод), уменьшая количество потребления продуктов и сокращая калорийность своего рациона, действительно улучшают разные показатели здоровья и продлевают молодость.
Оно влияет сразу на все механизмы старения, в том числе на длину теломер путем активации теломеразы. Люди, которые голодают хотя бы раз в неделю или делают промежутки между приемами пищи около 16–18 часов (интервальный голод), уменьшая количество потребления продуктов и сокращая калорийность своего рациона, действительно улучшают разные показатели здоровья и продлевают молодость.
При этом врач отмечает, что нужно оптимально сочетать голодание с другой полезной деятельностью. Если человек будет голодать, но при этом вести малоподвижный образ жизни и спать всего четыре-пять часов, то положительный эффект от такого голодания снижается в разы.
Вещества-«активаторы» теломеразы
В научном сообществе ведут поиски природных соединений, активизирующих работу теломеразы. Ученые изучают воздействие экстрактов некоторых растений на нее, обрабатывая ими клетки крови человека. Результаты многообещающие — например, экстракт центеллы азиатской увеличил активность теломеразы в 8,8 раз.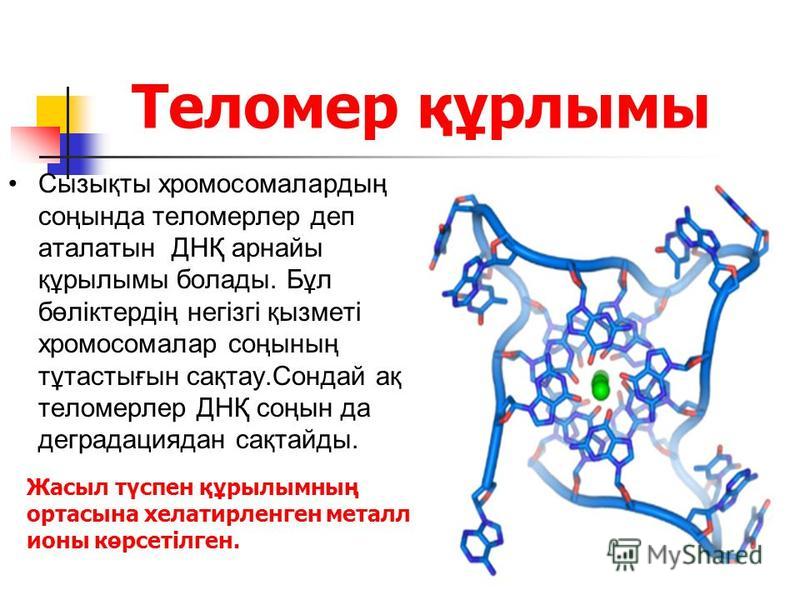 Исследователи полагают, что совместное воздействие питательных веществ и природных соединений, вероятно, даст лучший результат. Для этого нужны, в том числе, и клинические испытания на людях [21].
Исследователи полагают, что совместное воздействие питательных веществ и природных соединений, вероятно, даст лучший результат. Для этого нужны, в том числе, и клинические испытания на людях [21].
Элизабет Блэкберн также не отрицает пользу природных соединений и пищевых добавок. Она говорит, что жирные кислоты омега-3 связаны с сохранением теломер, а самый простой способ получить эти кислоты — принимать добавки. Омега-3 также содержатся в жирной рыбе и льняном семени. Есть некоторые данные, что и витамин D способен поддержать теломеры, но исследования в этом направлении только начинаются [22].
Как измерить длину своих теломер
Это можно сделать с помощью теста на измерение теломер, объясняет майер-терапевт Инна Решетова. Это специальный анализ, который обычно так и называется — тест на теломеры или измерение длины теломер. Он похож на стандартный биохимический анализ крови из вены — исследуется средняя длина концевых участков определенных клеток крови. Полученный результат сравнивают с нормой, которая должна быть у пациента в этом возрасте.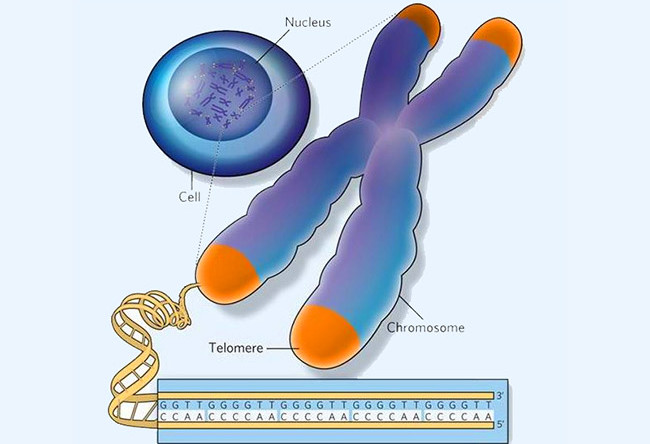 Если результат сильно больше или меньше нормы, это может говорить о патологии — болезни или воздействии негативных факторов.
Если результат сильно больше или меньше нормы, это может говорить о патологии — болезни или воздействии негативных факторов.
Длина теломер меняется со временем. Чтобы отслеживать эти изменения, нужно сдавать такой анализ приблизительно раз в полгода.
Теломеры и рак
Ученые также обнаружили взаимосвязь теломер с опасными заболеваниями, такими как, например, рак. Эксперименты идут в нескольких направлениях: исследуется связь между длинными теломерами и онкологией, механизм образования рака и воздействие на теломеразу в раковых клетках.
Длинные теломеры, возможно, провоцируют онкологию
Есть предположения, что чем длиннее теломеры, тем выше шанс дожить до развития онкологического заболевания. Подробнее об этом рассказала эндокринолог и специалист по превентивной и anti-age медицине Европейского медицинского центра Елена Островская.
Считается, что чем длиннее теломеры, тем больше у человека шансов прожить долгую жизнь. Но обычная клетка не просто так ограничивает количество своих делений.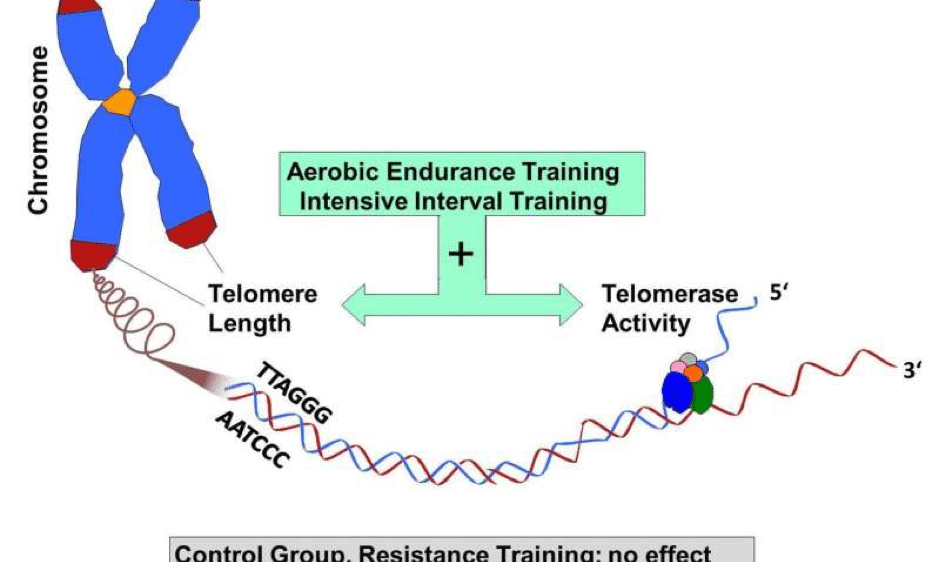 Чем дольше она живет, тем больше в ней накапливается поломок и изменений, которые развиваются под влиянием вредных факторов внешней среды. Это могут быть токсины, радиация, чрезмерная инсоляция, избыток пестицидов и гербицидов в окружающей среде, алкоголь и курение и другие. Чем больше таких факторов на нас действует, тем больше повреждений накапливается в клетках, потому что все эти факторы так или иначе повреждают ДНК. С поврежденной ДНК синтезируются дефектные белки. Они не так хорошо выполняют свои функции как раньше, и иногда накопление таких поломок может приводить к развитию раковых клеток. Исследования в этом направлении еще идут и однозначного ответа, как это происходит, пока нет [23].
Чем дольше она живет, тем больше в ней накапливается поломок и изменений, которые развиваются под влиянием вредных факторов внешней среды. Это могут быть токсины, радиация, чрезмерная инсоляция, избыток пестицидов и гербицидов в окружающей среде, алкоголь и курение и другие. Чем больше таких факторов на нас действует, тем больше повреждений накапливается в клетках, потому что все эти факторы так или иначе повреждают ДНК. С поврежденной ДНК синтезируются дефектные белки. Они не так хорошо выполняют свои функции как раньше, и иногда накопление таких поломок может приводить к развитию раковых клеток. Исследования в этом направлении еще идут и однозначного ответа, как это происходит, пока нет [23].
Изучение «бессмертия» раковых клеток
Многие виды раковых клеток имеют укороченные теломеры — например, раковые клетки поджелудочной железы, костей, простаты, мочевого пузыря, легких, почек, головы и шеи [24]. Это происходит потому, что, когда нормальная клетка трансформируется в раковую, она делится чаще, и ее теломеры становятся очень короткими.
Но если теломеры слишком коротки, это может привести к гибели клетки. И чтобы не погибнуть, раковые клетки вырабатывают много теломеразы. Она не дает теломерам сильно укорачиваться. Таким образом, раковые клетки, усиленно вырабатывая теломеразу, становятся практически бессмертными.
В большинстве видов рака теломераза поддерживает стабильную длину теломер, делая такие клетки потенциально бессмертными. На фото раковые клетки HeLa, выделенные в 1951 году из опухоли шейки матки Генриетты Лакс (Henrietta Lacks). Они живы и до сих пор используются цитологами — например, с их помощью была разработана вакцина против полиомиелита.
(Фото: National Institutes of Health (NIH))
Остановить теломеразу — победить рак?
Если ученые научатся останавливать теломеразу, чтобы она не удлиняла раковые клетки, то таким образом можно будет победить рак — раковые клетки будут постепенно укорачиваться, в итоге «постареют» и погибнут. Такие эксперименты уже проводились. Ученые блокировали активность теломеразы в клетках рака груди и простаты человека, растущих в лаборатории. Это привело к гибели опухолевых клеток [25].
Такие эксперименты уже проводились. Ученые блокировали активность теломеразы в клетках рака груди и простаты человека, растущих в лаборатории. Это привело к гибели опухолевых клеток [25].
Сейчас исследуются различные методы воздействия на теломеразу — противораковые вакцины, иммунотерапия и другие. Но пока что клинически одобренных стратегий, использующих теломеразу в качестве терапии рака, не существует [26].
Теломеры и победа над старостью
Существует больше сотни разных теорий старения. Сторонники теломерной теории полагают, что самое перспективное направления борьбы над старостью — это придумать способы, как помочь клеткам вырабатывать больше теломеразы и удлинить теломеры. При этом нужно учесть, что избыточная выработка теломеразы может увеличить риск развития раковых опухолей [27].
Глава одной из частных исследовательских компаний по биотехнологиям Элизабет Пэрриш (Elizabeth Parrish) заявила, что она добровольно подверглась экспериментальной генной терапии, которая направлена на борьбу с двумя самыми известными факторами старения: укорачиванием теломер и потерей мышечной массы. Успех терапии пока не подтвержден научным сообществом.
Успех терапии пока не подтвержден научным сообществом.
(Фото: выступление Пэрриш на TEDxOxford, Youtube)
Одним из решений может быть теломерная терапия (telomere therapy). Направленная только на стволовые клетки, она могла бы помочь другим клеткам обновляться и при этом не вызывать рак. Частные исследовательские центры совместно с учеными университетов также разрабатывают генную терапию теломеразы для лечения патологий, связанных с укорачиванием теломер, и со старением [28], [29].
Доктор медицинских наук Татьяна Бродовская отмечает, что ученые пока не уверены, можно ли увеличить продолжительность жизни, сохраняя или восстанавливая длину теломер с помощью теломеразы. Но они уже провели эксперименты с теломеразой, в которых человеческие клетки делились далеко за пределами своего нормального предела, и при этом не становились раковыми.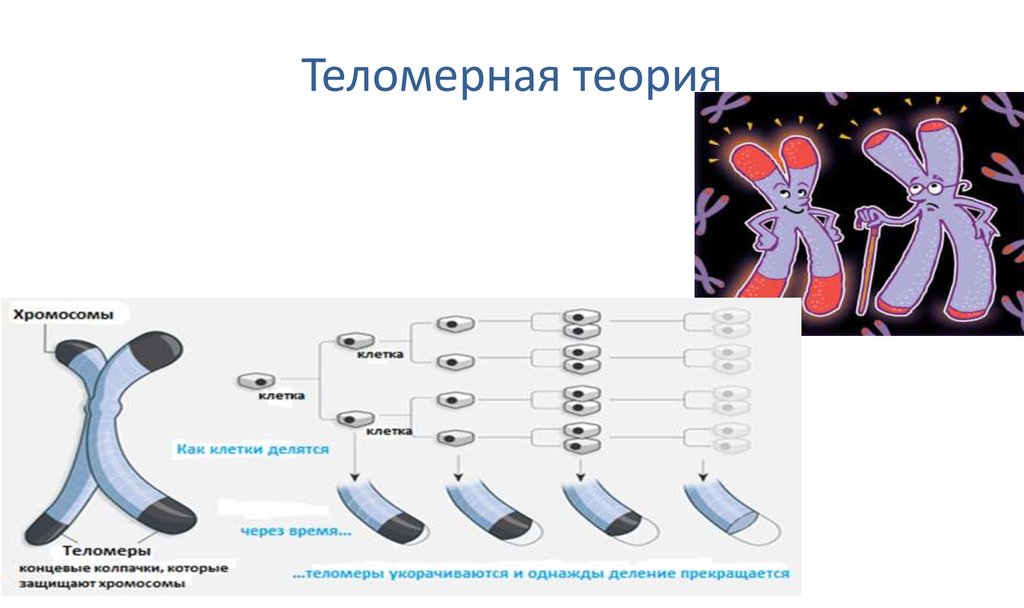
Если человечество сможет использовать теломеразу для удлинения жизни клеток, это дало бы возможность массово производить клетки для трансплантации — в том числе клетки, продуцирующие инсулин для лечения диабета, мышечные клетки для лечения мышечной дистрофии, хрящевые клетки для некоторых видов артрита и клетки кожи для заживления сильных ожогов и ран. Неограниченный запас нормальных человеческих клеток, выращенных в лаборатории, также мог бы помочь тестировать новые лекарства и в генной терапии.
Теломераза делает старение клеток безопаснее
09.09.2019
09.09.2019
Подготовил
Илья Скляр
Исследователи из университета штата Мэриленд и Национальных институтов здравоохранения США открыли новую роль теломеразы, фермента, связанного со старением и опухолеобразованием. Выяснилось, что теломераза активнее экспрессируется в стареющих клетках и что это может защитить их от трансформации в раковые.

Подготовил
Илья Скляр
Теломераза — фермент, предотвращающий укорачивание концевых участков хромосом (теломер) — играет важную роль в процессе эмбриогенеза и дифференциации стволовых клеток. В нормальных взрослых клетках теломераза не экспрессируется и теломеры укорачиваются с каждым делением. Когда они достигают критической длины, деление прекращается и запускается механизм клеточной смерти, однако в редких случаях повреждения ДНК могут привести к превращению клетки в раковую.
До сих пор считалось, что экспрессия теломеразы в большинстве взрослых клеток играет на стороне рака — способствует неконтролируемой пролиферации, которая имеет место у опухолевых клеток. Однако авторы статьи в PNAS показали, что это не совсем так.
Кань Цао из Университета штата Мэриленд и ее коллеги использовали для экспериментов специально выведенную линию мышей, у которых была репрессирована экспрессия теломеразы. Поскольку теломеры у мышей достаточно длинные по сравнению с человеческими, требуется много поколений, чтобы они стали критически короткими даже в отсутствие теломеразной активности. У таких мышей наблюдается сниженная продолжительность жизни, прогрессирующая атрофия тканей, спонтанные злокачественные новообразования.
Поскольку теломеры у мышей достаточно длинные по сравнению с человеческими, требуется много поколений, чтобы они стали критически короткими даже в отсутствие теломеразной активности. У таких мышей наблюдается сниженная продолжительность жизни, прогрессирующая атрофия тканей, спонтанные злокачественные новообразования.
Из 26-го поколения потомков скрещивания родителей, гетерозиготных по гену каталитической субъединицы теломеразы (mTert+/−) отбирали мышат-сиблингов с генотипами mTert+/+ и mTert−/−
— такие мыши генетически сходны во всех остальных отношениях, и теломеры у них одинаково короткие, разница только в наличии или отсутствии теломеразной активности.
Выяснилось, что фибробласты мышей, дефицитных по теломеразе (mTert−/−), раньше прекращали пролиферацию, чаще демонстрировали признаки злокачественной трансформации. С другой стороны, в фибробластах мышей mTert+/+, когда теломеры достигали критической длины, синтез теломеразы активировался. Это замедляло укорачивание теломер и уменьшало количество повреждений ДНК. По мнению авторов, это означает, что экспрессия теломеразы в конце жизни клетки полезна, она делает клеточное старение более плавным и безопасным, снижая вероятность опухолеобразования.
Это замедляло укорачивание теломер и уменьшало количество повреждений ДНК. По мнению авторов, это означает, что экспрессия теломеразы в конце жизни клетки полезна, она делает клеточное старение более плавным и безопасным, снижая вероятность опухолеобразования.
Эксперименты подтвердили, что реактивация экспрессии теломеразы «спасала» фибробласты с подавленной экспрессией, продлевая их способность делиться и уменьшая повреждения ДНК. Подавление экспрессии теломеразы в клетках дикого типа оказывало обратное действие. Аналогичные результаты были получены и на человеческих клетках.
По словам Цао, следующим этапом будет исследование механизмов активации экспрессии теломеразы в клетках с критической длиной теломер.
Источник
Linlin Sun et al. // Transient induction of telomerase expression mediates senescence and reduces tumorigenesis in primary fibroblasts // PNAS, first published September 3, 2019; DOI:
10. 1073/pnas.1907199116
1073/pnas.1907199116
Et сetera Онкология Молбиология Экспрессия генов Клеточная биология
Добавить в избранное
Подписаться
Иммунопептид PEPITEM снижает воспаление при ожирении
Температурозависимый арабидопсис и другие новости недели
Шанс попасть во вторую волну эпидемии довольно велик в Москве, но этот исход не выглядит неизбежным
Завлабы
Аполлинария Боголюбова: «Когда мы начинаем среди хаоса видеть путь, это мотивирует идти дальше»
Биохимия, теломеры и теломеразы — StatPearls
Введение
Теломеры представляют собой белковые структуры, расположенные на концах каждого хромосомного плеча эукариотической ДНК. Эти хромосомные колпачки являются одной из наиболее важных структур, сохраняющих структурную целостность линейной ДНК во время каждого цикла репликации.[1] Функции теломер включают защиту концов ДНК от связывания друг с другом и с самой собой, обеспечение полной репликации хромосом и выполнение функций молекулярного таймера, контролируя продолжительность жизни эукариотической клетки. Теломеры также предотвращают появление двухцепочечных разрывов ДНК на свободных концах хромосомы, что, в свою очередь, защищает концы от случайной репарации ДНК.[2] У людей теломеры играют важную роль в клеточном старении, внося большой вклад в старение человека. Патологически нарушение регуляции экспрессии механизма синтеза теломер вызывает клеточное бессмертие, что приводит к потенциальному онкогенезу и онкогенезу.[3]
Теломеры также предотвращают появление двухцепочечных разрывов ДНК на свободных концах хромосомы, что, в свою очередь, защищает концы от случайной репарации ДНК.[2] У людей теломеры играют важную роль в клеточном старении, внося большой вклад в старение человека. Патологически нарушение регуляции экспрессии механизма синтеза теломер вызывает клеточное бессмертие, что приводит к потенциальному онкогенезу и онкогенезу.[3]
Молекулярный
Теломер
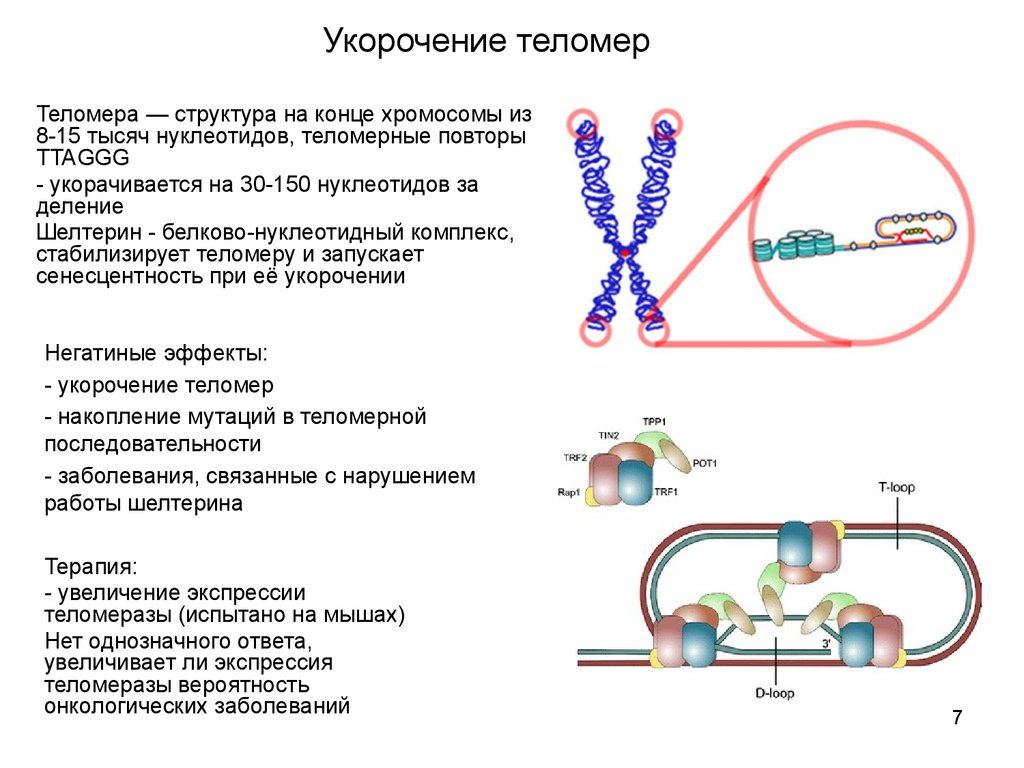
Теломерная структура состоит из повторов некодирующих азотистых оснований (5′-TTAGGG-3′). У млекопитающих теломеры в высокой степени консервативны, что указывает на то, что эта ядерная последовательность остается относительно неизменной на протяжении всей эволюционной биологии.[1] Гексамерные сегменты ДНК расположены в тандеме друг с другом. 3′-G-богатый конец хромосомы длиннее 5′-C-богатого конца.[4][5] У человека длина сегмента теломер составляет от 5000 до 15 000 пар оснований.[6] Этот длинный участок повторяющихся последовательностей ДНК характеризуется выступающим одноцепочечным 3′-концом, который заправляется в конец хромосомы, создавая конформацию, называемую Т-петлей. Следует отметить, что биохимическая структура Т-петли термодинамически неблагоприятна. Таким образом, белки необходимы для производства и поддержания Т-образной петли.[4]
Следует отметить, что биохимическая структура Т-петли термодинамически неблагоприятна. Таким образом, белки необходимы для производства и поддержания Т-образной петли.[4]
Теломера связана с шестью белками, которые в совокупности создают комплекс Шелтерин. Этот комплекс помогает создать окончательную структуру концевой крышки хромосомы. Ассоциированные белки описываются следующим образом: фактор связывания теломерных повторов 1 (TERF1 или TRF1) регулирует длину теломер. Фактор связывания теломерных повторов 2 (TERF2 или TRF2) стабилизирует Т-петлю. Защита теломер 1 (POT1) ингибирует реакцию повреждения ДНК на выступе одноцепочечной теломеры.[1][7] Фактор рекрутирования теломеразы (ACD или TPP1) облегчает связывание POT1 с одноцепочечной теломерной ДНК. TERF1, взаимодействующий с ядерным фактором 2 (TIN2 или TINF2), связывает POT1 и ACD с TERF1 и TERF2. TIN2 также отвечает за стабилизацию TERF2 на теломере. Белок 2, взаимодействующий с TERF (TERF2 или RAP1), в дополнение к белкам, упомянутым выше, отвечает за регуляцию длины теломер. ]
]
Теломераза
В синтезе теломер участвует теломераза с обратной транскриптазой, которая функционирует как РНК-зависимая ДНК-полимераза. Теломераза присутствует в зародышевых и стволовых клетках и имеет повышенную активность в раковых клетках. Этот фермент отвечает за удлинение теломер путем добавления de novo последовательностей TTAGGG на 3′-концы хромосом для предотвращения репликативного клеточного старения. Теломераза представляет собой рибонуклеопротеиновую структуру, состоящую из двух частей: функционального компонента РНК и компонента каталитической обратной транскриптазы. Компонент РНК содержит матрицу для синтеза теломерной ДНК. У человека функциональный компонент РНК называется hTERC или hTR [11]. Он кодируется геном TERC, расположенным в области 3q26 хромосомы. Компонент обратной транскриптазы называется hTERT и кодируется геном TERT, расположенным на хромосоме 5p13.33.[12]
Хотя основной комплекс теломеразы в основном состоит из двух основных компонентов, hTERC и hTERT, существуют важные поддерживающие белки для правильного функционирования всей структуры теломеразы.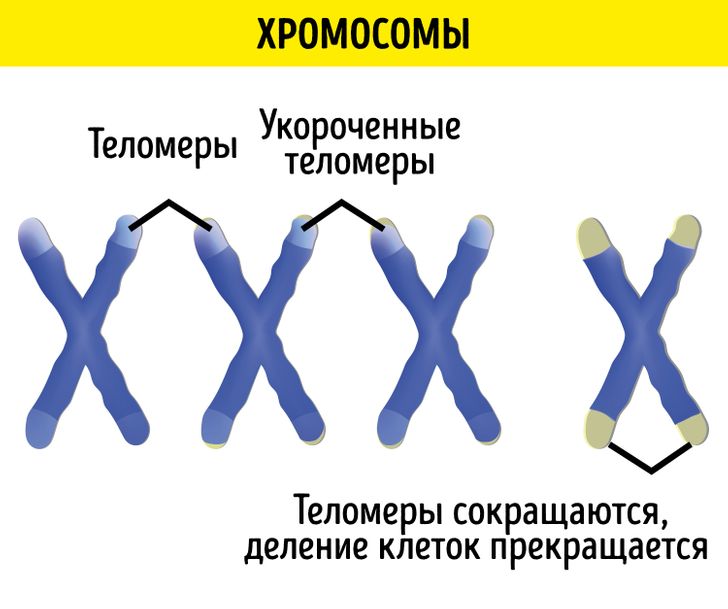 Tcab1, Gar1, Nhp2, рептин и понтин — это белки, которые необходимы для сборки теломеразы и правильного рекрутирования хромосом.[13][14] Следующими белками, ответственными за стабилизацию структуры теломеразы, являются TEP1 и дискерин. Наконец, дополнительные белковые субъединицы, Es1p и Es3p, помогают в сборке и созревании каталитического комплекса.
Tcab1, Gar1, Nhp2, рептин и понтин — это белки, которые необходимы для сборки теломеразы и правильного рекрутирования хромосом.[13][14] Следующими белками, ответственными за стабилизацию структуры теломеразы, являются TEP1 и дискерин. Наконец, дополнительные белковые субъединицы, Es1p и Es3p, помогают в сборке и созревании каталитического комплекса.
Функция
Основными функциями теломер являются поддержание стабильности хромосом и предотвращение хромосомной деградации. Кроме того, теломеры защищают концы хромосомы от соединения концов ДНК друг с другом или друг с другом, от реакции повреждения ДНК и случайной рекомбинации ДНК. Более длинный 3′-концевой выступ, богатый G, который создает Т-петлю, защищает конец этой хромосомы от появления двухцепочечного разрыва в цепи ДНК, тем самым предотвращая нежелательную репарацию ДНК. По этим причинам теломеры и их необходимое поддержание необходимы для стабильности генома эукариот и долговечности клеточной информации.
Механизм
Репликации ДНК способствует ДНК-полимераза.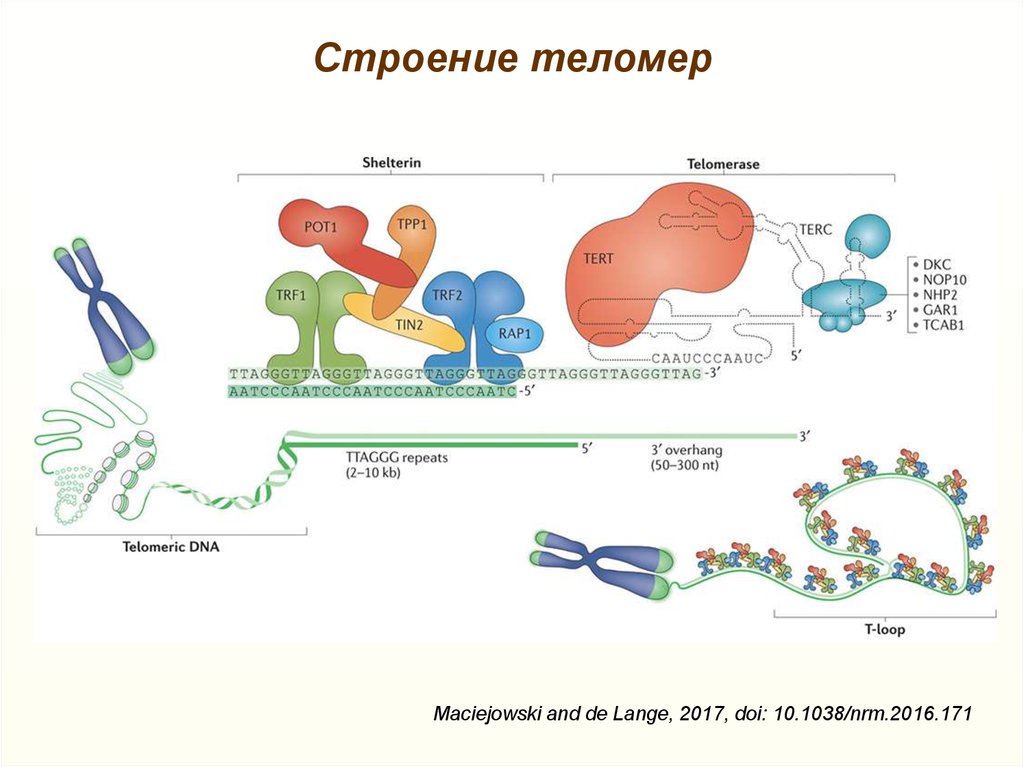 Этот фермент способен синтезировать ДНК только в направлении от 5′ к 3′. Репликация ДНК начинается с РНК-праймера, который синтезируется праймазой. Праймер РНК позволяет ДНК найти область хромосомы, где начнется репликация. Праймер РНК отжигается с матричной ДНК, чтобы обеспечить свободную группу 3′-ОН, куда добавляются новые нуклеотиды. Во время синтеза ведущей цепи, идущей от 5′-к 3′-направлению, требуется только один праймер, чтобы синтез в этом месте был непрерывным. Это связано с добавлением новых нуклеотидов в направлении репликационной вилки.[18] Одновременно синтез цепи ДНК происходит с запаздыванием в направлении от 3′ к 5′. Несколько праймеров РНК необходимы для отстающей цепи, которая затем заменяется нуклеотидами ДНК с помощью ДНК-полимеразы, затем удлиняется, а затем лигируется для создания новой цепи ДНК.[19]] Проблема возникает на 5′-конце отстающей цепи, где теряется участок ДНК размером с РНК-праймер. Эта «проблема конечной репликации» возникает, когда последний РНК-праймер удаляется после завершения репликации.
Этот фермент способен синтезировать ДНК только в направлении от 5′ к 3′. Репликация ДНК начинается с РНК-праймера, который синтезируется праймазой. Праймер РНК позволяет ДНК найти область хромосомы, где начнется репликация. Праймер РНК отжигается с матричной ДНК, чтобы обеспечить свободную группу 3′-ОН, куда добавляются новые нуклеотиды. Во время синтеза ведущей цепи, идущей от 5′-к 3′-направлению, требуется только один праймер, чтобы синтез в этом месте был непрерывным. Это связано с добавлением новых нуклеотидов в направлении репликационной вилки.[18] Одновременно синтез цепи ДНК происходит с запаздыванием в направлении от 3′ к 5′. Несколько праймеров РНК необходимы для отстающей цепи, которая затем заменяется нуклеотидами ДНК с помощью ДНК-полимеразы, затем удлиняется, а затем лигируется для создания новой цепи ДНК.[19]] Проблема возникает на 5′-конце отстающей цепи, где теряется участок ДНК размером с РНК-праймер. Эта «проблема конечной репликации» возникает, когда последний РНК-праймер удаляется после завершения репликации.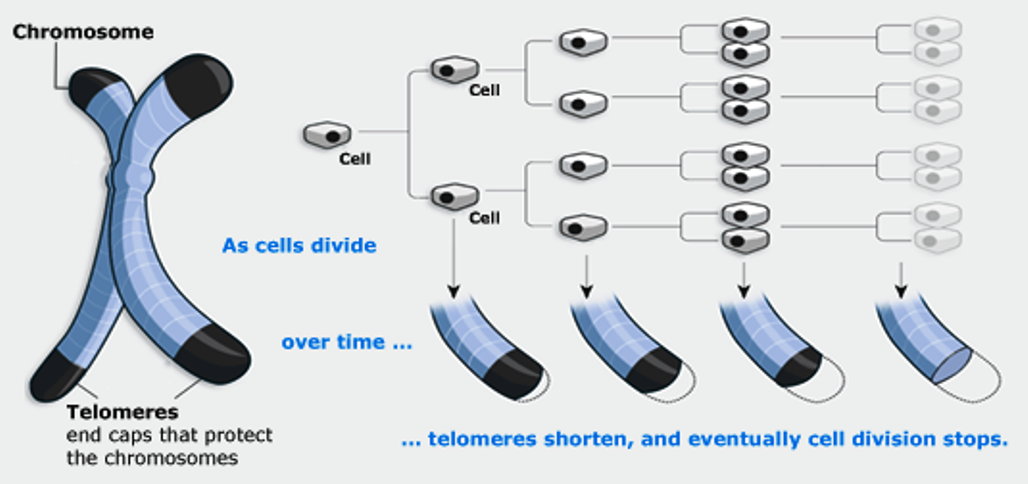 [20] ДНК-полимераза не может синтезировать конец отстающей цепи из-за отсутствия 3′-ОН группы после удаления РНК-праймера. Таким образом, благодаря врожденным свойствам ДНК-полимеразы, после каждой S фазы клеточного деления теломеры укорачиваются на 50-150 пар оснований.[21][22]
[20] ДНК-полимераза не может синтезировать конец отстающей цепи из-за отсутствия 3′-ОН группы после удаления РНК-праймера. Таким образом, благодаря врожденным свойствам ДНК-полимеразы, после каждой S фазы клеточного деления теломеры укорачиваются на 50-150 пар оснований.[21][22]
Репликация и поддержание теломер сопряжены с многочисленными проблемами. Повторяющиеся тандемные повторы ДНК предрасполагают к проскальзыванию ДНК-полимеразы во время репликации ДНК. Частое проскальзывание фермента может вызвать вставку или делецию нуклеотидных оснований, а также неправильное спаривание цепей. Следующей проблемой является G-богатая структура теломер. Более высокое количество гуаниновых нуклеотидов может вызвать образование G-квадруплексов. Связанные тетрады, богатые G, очень стабильны из-за увеличенного количества водородных связей. G-квадруплексы, для правильной разборки которых требуются специальные хеликазы, могут вызывать остановку вилки репликации, если специализированная хеликаза не может функционировать.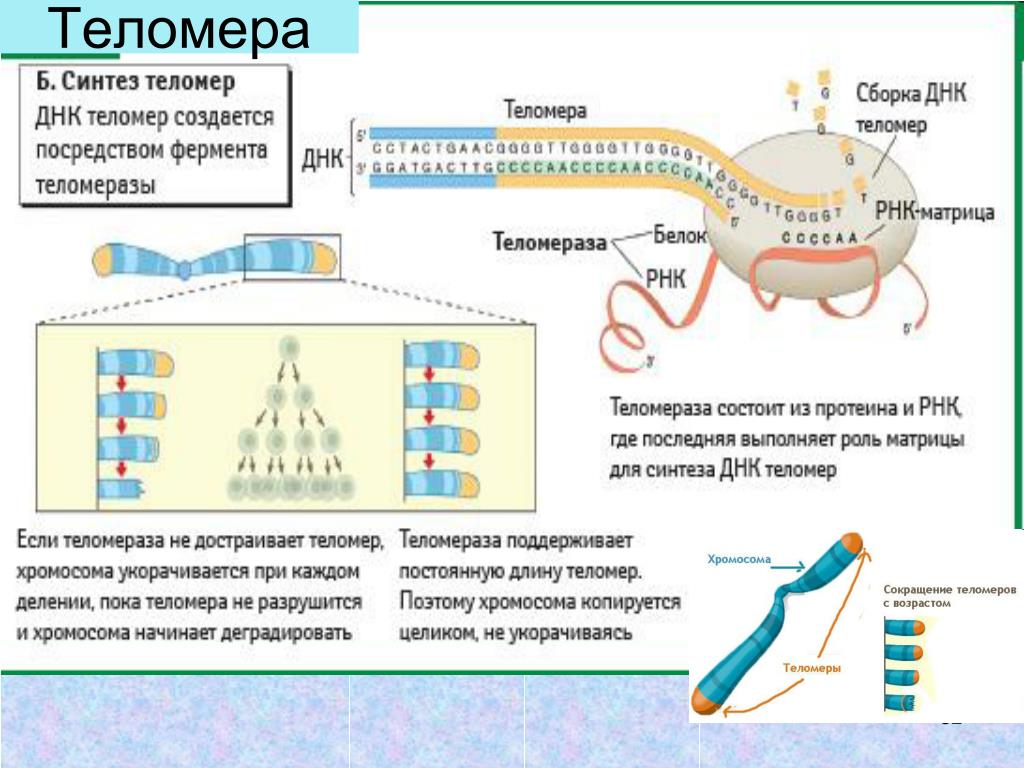 Кроме того, последний этап репликации теломер включает в себя раскручивание Т-петлей для облегчения прохождения реплисомы. При значительном структурном составе теломер неадекватное раскручивание может привести к невозможности своевременной разборки. Таким образом, механизм репликации не сможет скопировать конец хромосомы, что приведет к значительной потере последовательностей теломер. Для решения проблем, упомянутых выше, существуют теломерные белки, такие как факторы рекомбинации, зависящие от гомологии, специализированные хеликазы и нуклеазы, которые способствуют гладкой репликации теломер.
Кроме того, последний этап репликации теломер включает в себя раскручивание Т-петлей для облегчения прохождения реплисомы. При значительном структурном составе теломер неадекватное раскручивание может привести к невозможности своевременной разборки. Таким образом, механизм репликации не сможет скопировать конец хромосомы, что приведет к значительной потере последовательностей теломер. Для решения проблем, упомянутых выше, существуют теломерные белки, такие как факторы рекомбинации, зависящие от гомологии, специализированные хеликазы и нуклеазы, которые способствуют гладкой репликации теломер.
Патофизиология
Клеточное старение
Теломеры играют решающую роль в клеточном старении и, следовательно, в биологическом старении. Клеточное старение относится к необратимой потере способности клеток к делению. Проблема конечной репликации, которая описывает потерю пар оснований во время каждой S-фазы клеточного синтеза, может обнажить концы ДНК соматической клетки, активируя процесс, называемый реакцией на повреждение ДНК (DDR).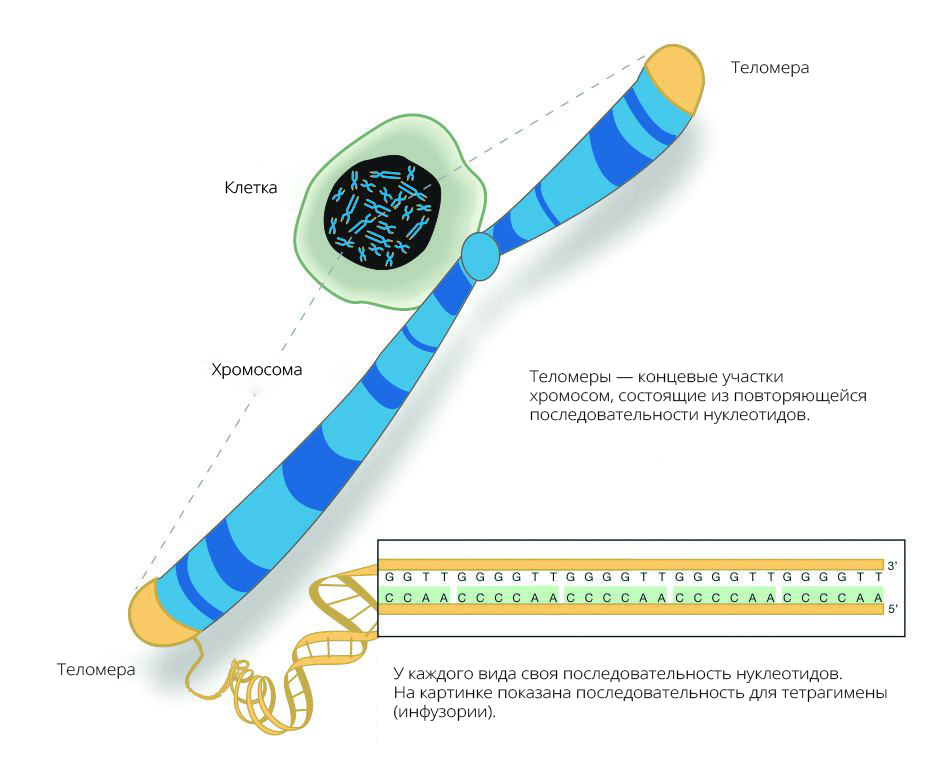 Целью этого явления является предотвращение аномального слияния открытых концов хромосом, а также хромосомной нестабильности. Без удлинения теломер, характерного для большинства соматических клеток, теломеры укорачиваются. Теломераза обладает способностью удлинять теломерные структуры; однако при постоянной активации ответа на повреждение теломерной ДНК, в дополнение к повреждению ДНК, будет выявлен сигнал, инициирующий старение. Клеточное старение или репликативное старение также начинается, когда длина теломер укорачивается ниже критической.[25][26] DDR включает несколько клеточных сигнальных путей, которые активируют контрольные точки клеточного цикла, чтобы предотвратить образование потенциально патофизиологических мутаций. В раковых клетках, как описано ниже в разделе «Клиническое значение», неограниченная способность к самообновлению приобретается за счет беспрепятственной активации теломеразы.[13]
Целью этого явления является предотвращение аномального слияния открытых концов хромосом, а также хромосомной нестабильности. Без удлинения теломер, характерного для большинства соматических клеток, теломеры укорачиваются. Теломераза обладает способностью удлинять теломерные структуры; однако при постоянной активации ответа на повреждение теломерной ДНК, в дополнение к повреждению ДНК, будет выявлен сигнал, инициирующий старение. Клеточное старение или репликативное старение также начинается, когда длина теломер укорачивается ниже критической.[25][26] DDR включает несколько клеточных сигнальных путей, которые активируют контрольные точки клеточного цикла, чтобы предотвратить образование потенциально патофизиологических мутаций. В раковых клетках, как описано ниже в разделе «Клиническое значение», неограниченная способность к самообновлению приобретается за счет беспрепятственной активации теломеразы.[13]
Клиническая значимость
Теломеры и окислительный стресс
ДНК-стрессоры включают многочисленные эндогенные и экзогенные факторы, такие как митохондриальная дисфункция, курение сигарет, употребление алкоголя, воспаление, диета с высоким содержанием жиров и другие факторы образа жизни и окружающей среды. [28][29] С ятрогенной точки зрения индукторы клеточного старения включают химиотерапию и облучение.[30][31] Самое главное, связь между этими индукторами и клеточным старением заключается в продукции активных форм кислорода (АФК). Исследователи считают, что теломеры, богатые G, особенно восприимчивы к окислительному стрессу.[32] Кроме того, теломеры имеют подавленную реакцию на повреждение ДНК, что приводит к неэффективному восстановлению ДНК при воздействии окислительного повреждения.
[28][29] С ятрогенной точки зрения индукторы клеточного старения включают химиотерапию и облучение.[30][31] Самое главное, связь между этими индукторами и клеточным старением заключается в продукции активных форм кислорода (АФК). Исследователи считают, что теломеры, богатые G, особенно восприимчивы к окислительному стрессу.[32] Кроме того, теломеры имеют подавленную реакцию на повреждение ДНК, что приводит к неэффективному восстановлению ДНК при воздействии окислительного повреждения.
Ожирение тесно связано с хроническим воспалением и повышенным уровнем АФК в жировой ткани. Эти пациенты с более высоким индексом массы тела (ИМТ) связаны с более высоким объемом крови, что приводит к большей пролиферации клеток крови — все это связано с укорочением теломер [29] [33]. Также сообщалось, что длина теломер обратно коррелирует с пациентами, которые страдают от психосоциального стресса и большого депрессивного расстройства из-за повышенного окислительного стресса и воспалительных факторов.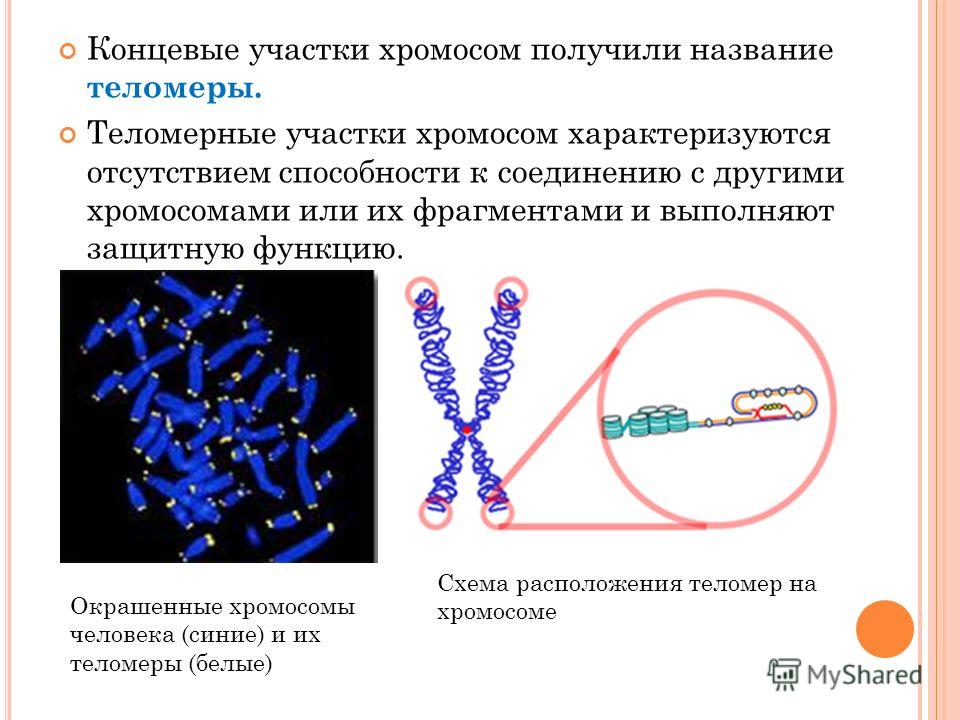 Примечательно, что сообщалось, что у тех, кто участвует в повышенных уровнях физической активности, теломеры длиннее.
Примечательно, что сообщалось, что у тех, кто участвует в повышенных уровнях физической активности, теломеры длиннее.
Рак
Хотя синтез теломер с помощью обратной транскриптазы, теломеразы, отсутствует в большинстве соматических клеток человека, он обнаруживается более чем в 90% онкогенных клеток и иммортализованных клеток in vitro.[37] Теломераза приобретает онкогенную функцию, когда ее экспрессия нарушается в соматических клетках человека.[2][12] Амплификация гена hTERT, возникающая в результате разрыва участков ДНК или аномального слияния хромосом, вызывает патологическую активацию теломеразной активности. Иммортализация раковых клеток за счет участия hTERT также может происходить за счет метилирования промотора hTERT. Метилирование предотвращает связывание репрессоров транскрипции и блокирование механизма транскрипции. Мутации промотора TERT также обнаруживаются в раковых клетках, включая уроэпителиальные клетки, клетки мочевого пузыря, щитовидной железы, меланому кожи, базально-клеточный рак, плоскоклеточный рак и глиобластому.
Иммунотерапия рака, нацеленная на теломеразу
Поскольку повышенная активность теломеразы имеет большое значение в опухолевых клетках, hTERT представляет собой привлекательный опухолевый антиген для иммунотерапии рака, направленной на теломеразу. Существует несколько подходов, включая ингибиторы олигонуклеотидов, иммунотерапевтические подходы и генную терапию, направленную на теломеразу. Ингибиторы олигонуклеотидов представляют собой модифицированные нуклеиновые кислоты, которые способны ингибировать теломеразу, тем самым вызывая укорочение теломер и принудительное клеточное старение и апоптоз. Иммунотерапевтические подходы используют Т-лимфоциты с высокой авидностью, которые реагируют на каталитический фермент. Наконец, генная терапия, направленная на теломеразу, включает избирательное уничтожение опухолевых клеток путем нацеливания на промоторы теломеразы.[39]]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.

Комментарий к этой статье.
Ссылки
- 1.
Тернер К.Дж., Васу В., Гриффин Д.К. Биология теломер и фенотип человека. Клетки. 2019 Jan 19;8(1) [Бесплатная статья PMC: PMC6356320] [PubMed: 30669451]
- 2.
Конг Ю.С., Райт В.Е., Шэй Дж.В. Теломераза человека и ее регуляция. Microbiol Mol Biol Rev. 2002 Sep;66(3):407-25, оглавление. [Бесплатная статья PMC: PMC120798] [PubMed: 12208997]
- 3.
Бехарано Л., Боссо Г., Лузаме Дж., Серрано Р., Гомес-Касеро Э., Мартинес-Торрекуадрада Дж., Мартинес С., Бланко-Апарисио С., Пастор М.А., Бласко . Множественные пути рака регулируют защиту теломер. EMBO Мол Мед. 2019 июль;11(7):e10292. [Бесплатная статья PMC: PMC6609915] [PubMed: 31273934]
- 4.
Джардини М.А., Сегатто М., да Силва М.С., Нуньес В.С., Кано М.И. Биология теломер и теломеразы. Prog Mol Biol Transl Sci. 2014; 125:1-40. [В паблике: 24993696]
- 5.

Райт В.Е., Тесмер В.М., Хаффман К.Е., Левен С.Д., Шэй Дж.В. Нормальные человеческие хромосомы имеют длинные G-богатые теломерные выступы на одном конце. Гены Дев. 1997 01 ноября; 11 (21): 2801-9. [Статья бесплатно PMC: PMC316649] [PubMed: 9353250]
- 6.
Ахмед В., Лингнер Дж. Влияние окислительного стресса на биологию теломер. Дифференциация. 2018 янв-февраль;99:21-27. [PubMed: 29274896]
- 7.
de Lange T. Shelterin: белковый комплекс, формирующий и защищающий теломеры человека. Гены Дев. 2005 15 сентября; 19(18):2100-10. [PubMed: 16166375]
- 8.
Xin H, Liu D, Songyang Z. Комплекс телосома/шелтерин и его функции. Геном биол. 2008;9(9):232. [Бесплатная статья PMC: PMC2592706] [PubMed: 18828880]
- 9.
Lazzerini-Denchi E, Sfeir A. Перестаньте дергать меня за ниточки — чему теломеры научили нас о реакции на повреждение ДНК. Nat Rev Mol Cell Biol. 2016 июнь; 17 (6): 364-78.
 [Бесплатная статья PMC: PMC5385261] [PubMed: 27165790]
[Бесплатная статья PMC: PMC5385261] [PubMed: 27165790]- 10.
Грейдер CW, Блэкберн EH. Идентификация специфической терминальной трансферазной активности теломер в экстрактах Tetrahymena. Клетка. 1985 декабрь; 43 (2 часть 1): 405-13. [PubMed: 3907856]
- 11.
Feng J, Funk WD, Wang SS, Weinrich SL, Avilion AA, Chiu CP, Adams RR, Chang E, Allsopp RC, Yu J. РНК-компонент теломеразы человека. Наука. 1995 г., 01 сентября; 269(5228):1236-41. [PubMed: 7544491]
- 12.
Zhang Y, Toh L, Lau P, Wang X. Обратная транскриптаза теломеразы человека (hTERT) является новой мишенью пути Wnt/β-катенина при раке человека. Дж. Биол. Хим. 2012 21 сентября; 287(39)):32494-511. [Статья бесплатно PMC: PMC3463325] [PubMed: 22854964]
- 13.
Leão R, Apolónio JD, Lee D, Figueiredo A, Tabori U, Castelo-Branco P. Механизмы регуляции обратной транскриптазы теломеразы человека (hTERT) : клинические последствия при раке.
 J биомедицинских наук. 2018 12 марта; 25 (1): 22. [Бесплатная статья PMC: PMC5846307] [PubMed: 29526163]
J биомедицинских наук. 2018 12 марта; 25 (1): 22. [Бесплатная статья PMC: PMC5846307] [PubMed: 29526163]- 14.
Venteicher AS, Meng Z, Mason PJ, Veenstra TD, Artandi SE. Идентификация АТФаз понтина и рептина как компонентов теломеразы, необходимых для сборки холофермента. Клетка. 2008 21 марта; 132(6):945-57. [Бесплатная статья PMC: PMC2291539] [PubMed: 18358808]
- 15.
Cohen SB, Graham ME, Lovrecz GO, Bache N, Robinson PJ, Reddel RR. Белковый состав каталитически активной теломеразы человека из иммортализованных клеток. Наука. 2007 г., 30 марта; 315(5820):1850-3. [PubMed: 17395830]
- 16.
Лю Л., Лай С., Эндрюс Л.Г., Толлефсбол Т.О. Генетическая и эпигенетическая модуляция активности теломеразы в развитии и заболевании. Ген. 2004 г., 29 сентября; 340 (1): 1–10. [В паблике: 15556289]
- 17.
Стройк С., Хендриксон Э.А. Репликация теломер — когда дела идут плохо. Восстановление ДНК (Amst).
 2020 окт;94:102875. [PubMed: 32650286]
2020 окт;94:102875. [PubMed: 32650286]- 18.
Ohki R, Tsurimoto T, Ishikawa F. Реконструкция in vitro проблемы репликации конца. Мол Селл Биол. 2001 сен; 21 (17): 5753-66. [Бесплатная статья PMC: PMC87295] [PubMed: 11486015]
- 19.
Окадзаки Р., Оказаки Т., Сакабе К., Сугимото К., Сугино А. Механизм роста цепи ДНК. I. Возможная разрывность и необычная вторичная структура вновь синтезированных цепей. Proc Natl Acad Sci U S A. 1968 февраля; 59 (2): 598-605. [Бесплатная статья PMC: PMC224714] [PubMed: 4967086]
- 20.
Watson JD. Происхождение конкатемерной ДНК Т7. Нэт Нью Биол. 1972 г., 18 октября; 239 (94): 197–201. [PubMed: 4507727]
- 21.
Маэстрони Л., Матмати С., Кулон С. Решение проблемы репликации теломер. Гены (Базель). 31 января 2017 г., 8(2) [бесплатная статья PMC: PMC5333044] [PubMed: 28146113]
- 22.
Griffith JD, Comeau L, Rosenfield S, Stansel RM, Bianchi A, Moss H, de Lange T.
 Теломеры млекопитающих заканчиваются большой дуплексной петлей. Клетка. 1999 14 мая; 97(4):503-14. [PubMed: 10338214]
Теломеры млекопитающих заканчиваются большой дуплексной петлей. Клетка. 1999 14 мая; 97(4):503-14. [PubMed: 10338214]- 23.
Vannier JB, Pavicic-Kaltenbrunner V, Petalcorin MI, Ding H, Boulton SJ. RTEL1 демонтирует Т-петли и противодействует теломерной G4-ДНК, чтобы поддерживать целостность теломер. Клетка. 2012 11 мая; 149 (4): 795-806. [PubMed: 22579284]
- 24.
Стройк С., Курц К., Хендриксон Э.А. CtIP необходим для репликации теломер. Нуклеиновые Кислоты Res. 2019 26 сентября; 47 (17): 8927-8940. [Бесплатная статья PMC: PMC6755089] [PubMed: 31378812]
- 25.
d’Adda di Fagagna F, Reaper PM, Clay-Farrace L, Fiegler H, Carr P, Von Zglinicki T, Saretzki G, Carter NP, Jackson SP. Реакция контрольной точки повреждения ДНК при старении, инициированном теломерами. Природа. 2003 13 ноября; 426 (6963): 194-8. [PubMed: 14608368]
- 26.
Агуадо Дж., д’Адда ди Фаганья Ф., Вольветанг Э. Транскрипция теломер при старении.
 Aging Res Rev. 2020 Sep;62:101115. [PubMed: 32565330]
Aging Res Rev. 2020 Sep;62:101115. [PubMed: 32565330]- 27.
Россиелло Ф., Агуадо Дж., Сепе С., Яннелли Ф., Нгуен К., Питчиайя С., Карнинчи П., д’Адда ди Фаганья Ф. Исправление: Ингибирование реакции на повреждение ДНК на дисфункциональных теломерах путем модуляции РНК реакции на повреждение теломерной ДНК . Нац коммун. 2017 13 апр;8:15344. [Бесплатная статья PMC: PMC5399297] [PubMed: 28406145]
- 28.
Wiley CD, Velarde MC, Lecot P, Liu S, Sarnoski EA, Freund A, Shirakawa K, Lim HW, Davis SS, Ramanathan A, Геренсер А.А., Вердин Э., Кампизи Дж. Митохондриальная дисфункция вызывает старение с отчетливым секреторным фенотипом. Клеточный метаб. 2016 Фев 09;23(2):303-14. [Статья бесплатно PMC: PMC4749409] [PubMed: 26686024]
- 29.
McGrath M, Wong JY, Michaud D, Hunter DJ, De Vivo I. Длина теломер, курение сигарет и риск рака мочевого пузыря у мужчин и женщин . Эпидемиологические биомаркеры рака Prev. 2007 Апрель; 16 (4): 815-9.
 [PubMed: 17416776]
[PubMed: 17416776]- 30.
Чайлдс Б.Г., Дурик М., Бейкер Д.Дж., ван Дерсен Дж.М. Клеточное старение при старении и возрастных заболеваниях: от механизмов к терапии. Нат Мед. 2015 дек; 21(12):1424-35. [Бесплатная статья PMC: PMC4748967] [PubMed: 26646499]
- 31.
Финкель Т., Холбрук, Нью-Джерси. Оксиданты, окислительный стресс и биология старения. Природа. 2000 09 ноября; 408 (6809): 239-47. [PubMed: 11089981]
- 32.
Oikawa S, Kawanishi S. Сайт-специфическое повреждение ДНК в последовательности GGG окислительным стрессом может ускорить укорочение теломер. ФЭБС лат. 1999 25 июня; 453 (3): 365-8. [PubMed: 10405177]
- 33.
Эпель Э.С. Психологический и метаболический стресс: рецепт ускоренного старения клеток? Гормоны (Афины). 2009 г.янв-март;8(1):7-22. [PubMed: 19269917]
- 34.
Волковиц О.М., Меллон С.Х., Эпель Э.С., Лин Дж., Дхабхар Ф.С., Су Ю, Реус В.И.
 , Россер Р., Берк Х.М., Купферман Э., Компаньон М., Нельсон Дж.С., Блэкберн ЭХ. Длина теломер лейкоцитов при большой депрессии: корреляция с хроническим течением, воспалением и окислительным стрессом — предварительные данные. ПЛОС Один. 2011 23 марта; 6 (3): e17837. [Бесплатная статья PMC: PMC3063175] [PubMed: 21448457]
, Россер Р., Берк Х.М., Купферман Э., Компаньон М., Нельсон Дж.С., Блэкберн ЭХ. Длина теломер лейкоцитов при большой депрессии: корреляция с хроническим течением, воспалением и окислительным стрессом — предварительные данные. ПЛОС Один. 2011 23 марта; 6 (3): e17837. [Бесплатная статья PMC: PMC3063175] [PubMed: 21448457]- 35.
Путерман Э., Лин Дж., Блэкберн Э., О’Донован А., Адлер Н., Эпель Э. Сила упражнений: буферизация эффекта хронического нагрузка на длину теломер. ПЛОС Один. 2010 г., 26 мая; 5(5):e10837. [Бесплатная статья PMC: PMC2877102] [PubMed: 20520771]
- 36.
Ладлоу А.Т., Циммерман Дж.Б., Витковски С., Хирн Дж.В., Хэтфилд Б.Д., Рот С.М. Взаимосвязь между уровнем физической активности, длиной теломер и активностью теломеразы. Медицинские спортивные упражнения. 2008 Октябрь; 40 (10): 1764-71. [Бесплатная статья PMC: PMC2581416] [PubMed: 18799986]
- 37.
Ким Н.В., Пятишек М.А., Prowse KR, Harley CB, West MD, Ho PL, Coviello GM, Wright WE, Weinrich SL, Shay JW.
 Специфическая ассоциация активности теломеразы человека с бессмертными клетками и раком. Наука. 1994 23 декабря; 266(5193):2011-5. [PubMed: 7605428]
Специфическая ассоциация активности теломеразы человека с бессмертными клетками и раком. Наука. 1994 23 декабря; 266(5193):2011-5. [PubMed: 7605428]- 38.
Azouz A, Wu YL, Hillion J, Tarkanyi I, Karniguian A, Aradi J, Lanotte M, Chen GQ, Chehna M, Ségal-Bendirdjian E. Эпигенетическая пластичность гена hTERT промотор определяет способность ретиноидов подавлять теломеразу в устойчивых к созреванию клетках острого промиелоцитарного лейкоза. Лейкемия. 2010 март; 24(3):613-22. [PubMed: 20072159]
- 39.
Jäger K, Walter M. Терапевтическое нацеливание на теломеразу. Гены (Базель). 21 июля 2016 г.; 7(7) [бесплатная статья PMC: PMC4962009] [PubMed: 27455328]
Видео: связь между теломеразой и старением
| от RepeatDx | Опубликовано в: Новости
Ключом к поддержанию здоровья наших клеток может быть фермент теломераза.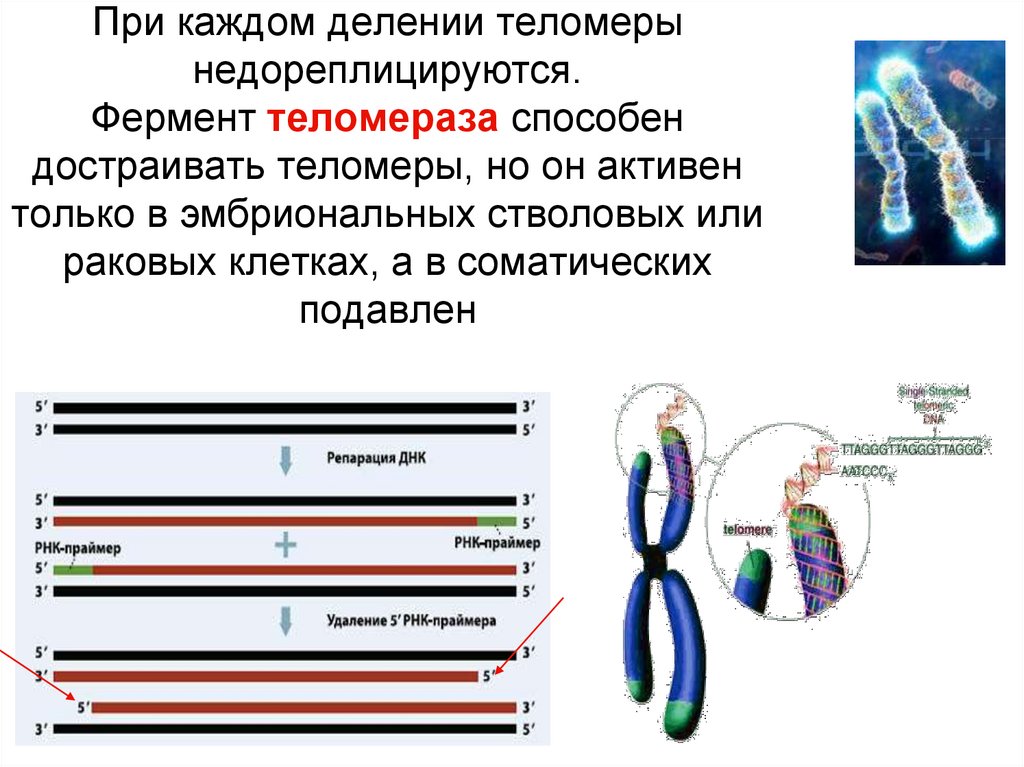 В этом видео мы рассказываем, как теломераза помогает поддерживать длину теломер в наших клетках, и как это влияет на то, как стареет наш организм, и почему у нас развиваются такие заболевания, как рак.
В этом видео мы рассказываем, как теломераза помогает поддерживать длину теломер в наших клетках, и как это влияет на то, как стареет наш организм, и почему у нас развиваются такие заболевания, как рак.
Со временем, с каждым клеточным делением, теломеры укорачиваются. Когда теломеры слишком короткие, запускается реакция на повреждение ДНК, и клетки получают сигнал прекратить деление (старение) или умереть (апоптоз).
Теломераза — это обратная транскриптаза, которая помогает поддерживать длину теломер в наших клетках. Теломераза связывается с теломерой и удлиняет ДНК, затем движется вниз по ней, повторяя этот процесс и удлиняя выступ.
В этом видео мы демонстрируем механизм удлинения ДНК теломеразой, поддерживая длину теломер в наших клетках.
Мы также изучаем, что может произойти, если присутствует слишком много или слишком мало теломеразы, и как это может иметь такие последствия, как рак или расстройства биологии теломер.
Это часть серии из шести видеороликов, в которых мы исследуем теломеры, длину теломер и теломеразу, а также их влияние на наше здоровье и старение.
Далее смотрите видео, объясняющее расстройства биологии теломер.
Чтобы узнать больше о проблеме репликации концов и о том, как укорачивание теломер влияет на старение, посмотрите это видео.
RepeatDx — ведущая клиническая лаборатория по тестированию длины теломер. Вы можете узнать больше о тестировании длины теломер с помощью RepeatDx здесь.
Следуйте за нами в Твиттере: @RepeatDx
Ссылки
Обер Г., Лэнсдорп ПМ. Теломеры и старение. Physiol Rev. 2008;88(2):557-579. doi:10.1152/physrev.00026.2007.
Бартель, Ф.П., Вей, В., Танг, М., Мартинес-Ледесма, Э., Ху, X.

 [Бесплатная статья PMC: PMC5385261] [PubMed: 27165790]
[Бесплатная статья PMC: PMC5385261] [PubMed: 27165790] J биомедицинских наук. 2018 12 марта; 25 (1): 22. [Бесплатная статья PMC: PMC5846307] [PubMed: 29526163]
J биомедицинских наук. 2018 12 марта; 25 (1): 22. [Бесплатная статья PMC: PMC5846307] [PubMed: 29526163] 2020 окт;94:102875. [PubMed: 32650286]
2020 окт;94:102875. [PubMed: 32650286] Теломеры млекопитающих заканчиваются большой дуплексной петлей. Клетка. 1999 14 мая; 97(4):503-14. [PubMed: 10338214]
Теломеры млекопитающих заканчиваются большой дуплексной петлей. Клетка. 1999 14 мая; 97(4):503-14. [PubMed: 10338214] Aging Res Rev. 2020 Sep;62:101115. [PubMed: 32565330]
Aging Res Rev. 2020 Sep;62:101115. [PubMed: 32565330]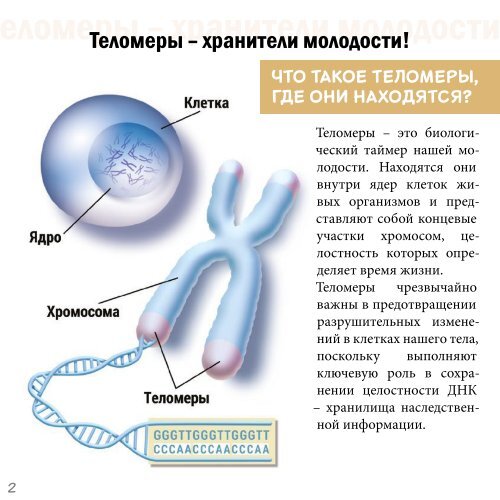 [PubMed: 17416776]
[PubMed: 17416776]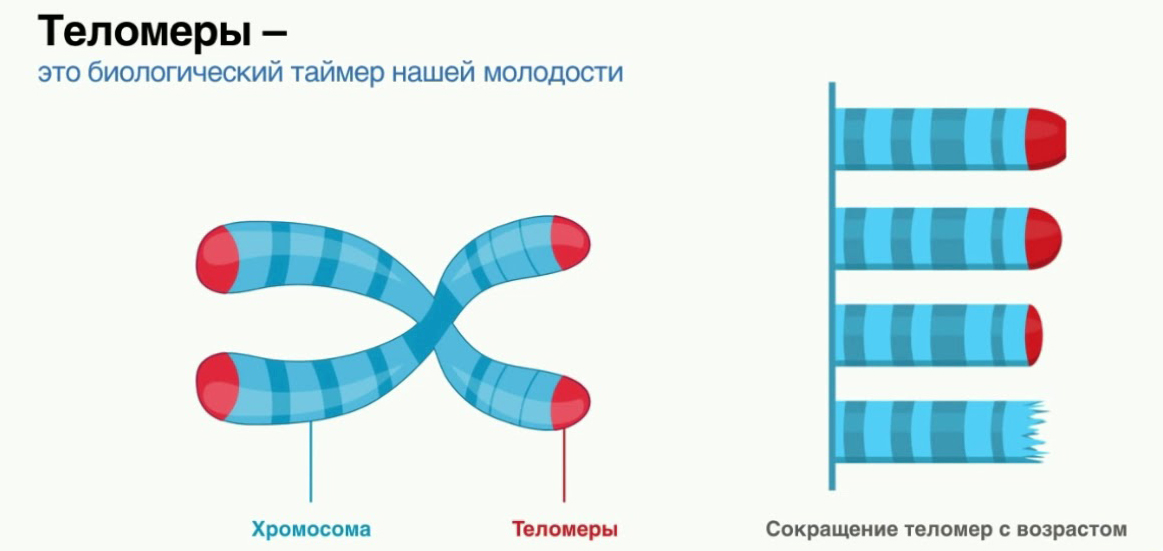 , Россер Р., Берк Х.М., Купферман Э., Компаньон М., Нельсон Дж.С., Блэкберн ЭХ. Длина теломер лейкоцитов при большой депрессии: корреляция с хроническим течением, воспалением и окислительным стрессом — предварительные данные. ПЛОС Один. 2011 23 марта; 6 (3): e17837. [Бесплатная статья PMC: PMC3063175] [PubMed: 21448457]
, Россер Р., Берк Х.М., Купферман Э., Компаньон М., Нельсон Дж.С., Блэкберн ЭХ. Длина теломер лейкоцитов при большой депрессии: корреляция с хроническим течением, воспалением и окислительным стрессом — предварительные данные. ПЛОС Один. 2011 23 марта; 6 (3): e17837. [Бесплатная статья PMC: PMC3063175] [PubMed: 21448457] Специфическая ассоциация активности теломеразы человека с бессмертными клетками и раком. Наука. 1994 23 декабря; 266(5193):2011-5. [PubMed: 7605428]
Специфическая ассоциация активности теломеразы человека с бессмертными клетками и раком. Наука. 1994 23 декабря; 266(5193):2011-5. [PubMed: 7605428]