Линолевая кислота. Свойства, особенности, сфера применения
Линолевая кислота
CAS номер: 60-33-3
Брутто формула: C18h42O2
Внешний вид: маслянистая жидкость желтого цвета.
Химическое название: Linoleic acid, (Z,Z)-9,12-Octadecadienoic acid; cis-9,cis-12-Octadecadienoic acid; Linolic acid.
Физико-химические свойства:
Молекулярный вес 280.45 г/моль
Плотность 0,902
Температура плавления -5 ºC
Температура кипения 229-230°С (16 мм рт.ст.)
Показатель преломления 1.4687-1.4707
Растворимость: Субстанция растворима в метаноле, ацетоне. Нерастворима в холодной воде.
Опасные продукты, образующиеся в результате горения: монооксид углерода, двуокись углерода и фтористый водород.
Описание:
Линолевая кислота (также называемая цис, цис, -9,12-октадекадиеновая кислота) является примером полиненасыщенной жирной кислоты из-за наличия двойных связей C = C. Она представляет собой омега-6 жирную кислоту. Это основная жирная кислота, содержащаяся в растительных маслах, таких как соевое, кукурузное, рапсовое. Ее используют для производства маргарина, кулинарных масел, а также мыла, эмульгаторов и быстросохнущих масел.
Она представляет собой омега-6 жирную кислоту. Это основная жирная кислота, содержащаяся в растительных маслах, таких как соевое, кукурузное, рапсовое. Ее используют для производства маргарина, кулинарных масел, а также мыла, эмульгаторов и быстросохнущих масел.
Линолевая кислота относится к одному из двух классов незаменимых жирных кислот, которые необходимы организму человека и животных. Если человек не потребляет достаточное количество этих эссенциальных жирных кислот, то могут возникнуть некоторые проблемы со здоровьем. Экспериментальный рацион с недостаточным количеством линолеата (солевая форма кислоты) вызывает умеренное поражение кожи, выпадение волос и нарушения в процессе восстановлении кожи. Линолевая кислота выполняет особую роль в поддержании здоровья сердца. Рандомизированные клинические испытания показали, что замена насыщенного жира в пище линолевой кислотой снижает общее количество холестерина ЛПНП(липопротеины низкой плотности). Имеются также некоторые свидетельства того, что линолевая кислота улучшает чувствительность к инсулину и нормализует артериальное давление.
Двумя семействами EFA (ненасыщенных жирных кислот) являются ω-3 (или омега-3 или n-3), которые поступают из рыбьего жира, и ω-6 (омега 6, n-6) — из растительных масел (одна из них — линолевая кислота). Когда в 1923 году они были обнаружены в качестве важных питательных веществ, два семейства незаменимых жирных кислот были обозначены как «витамин F». Но примерно в 1930 году было установлено, что они лучше классифицируются с жирами, чем с витаминами, поэтому название «витамин F» было заменено.
Применение:
Поскольку линолевая кислота является основным питательным веществом, она обычно добавляется в энтеральные, парентеральные формы и детские смеси, где содержание жира может варьироваться в зависимости от конкретного использования. Существуют также средства с линолевой кислотой, предназначенные для местного писпользования: кремы, мази и др. При местном применении линолевая кислота помогает лечить расстройства кожи, связанные с ее дефицитом.
Линолевая кислота и ее изомер (конъюгированная линолевая кислота) активно используются в специальном спортивном питании для похудения за счет уменьшения подкожного жира. Также применяется в ряде БАДов, принимаемых для снижения риска заболеваний сердечно-сосудистой системы и даже для профилактики онкологических заболеваний. Также назначается в составе комплексной терапии при болезни Альцгеймера, показывая положительный эффект в патогенезе болезни на ранней стадии процесса.
Получение:
Промышленный синтез линоленовой кислоты состоит в следующем. Вначале получают этиловый эфир линолевой кислоты путем смешивания 3-х компонентов: тетрабромстеариновой кислоты (перекристаллизованная), абсолютного этилового спирта и гранулированного цинка. Полученную смесь нагревают, учитывая, что реакция экзотермическая, периодически охлаждают. Минут через 5, когда начнется реакция отщепления брома, смесь помещают в обратный холодильник и она поддается кипячению 30 минут.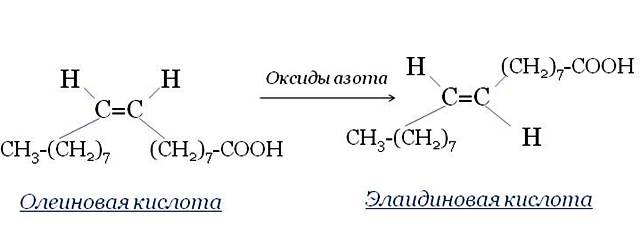 Затем с определенным интервалом приливают раствор хлористого водорода. Полученную смесь совмещают с раствором поваренной соли, дожидаясь расслоения. Затем эмульсию центрифугируют и промывают.
Затем с определенным интервалом приливают раствор хлористого водорода. Полученную смесь совмещают с раствором поваренной соли, дожидаясь расслоения. Затем эмульсию центрифугируют и промывают.
Полученный эфир растворяют спиртовым 95% денатурированным раствором едкого натра и оставляют на ночь при комнатной температуре. Эту массу растворяют теплой водой с добавлением углекислого газа и разбавленной серной кислоты. Линолевая кислота всплывает на поверхность в виде прозрачного слоя. Полученную кислоту хранят под углекислым газом.
Действие на организм:
Линолевая кислота (18: 2ω6, цис, цис-9,12-октадекадиеновая кислота) является наиболее сильно потребляемой ПНЖК, обнаруженной в рационе человека. При потреблении линолевая кислота совершает 4 первичных пути. Как и все жирные кислоты, ее можно использовать как источник энергии. Ее можно этерифицировать с образованием нейтральных и полярных липидов, таких как фосфолипиды, триацилглицерины и сложные эфиры холестерина.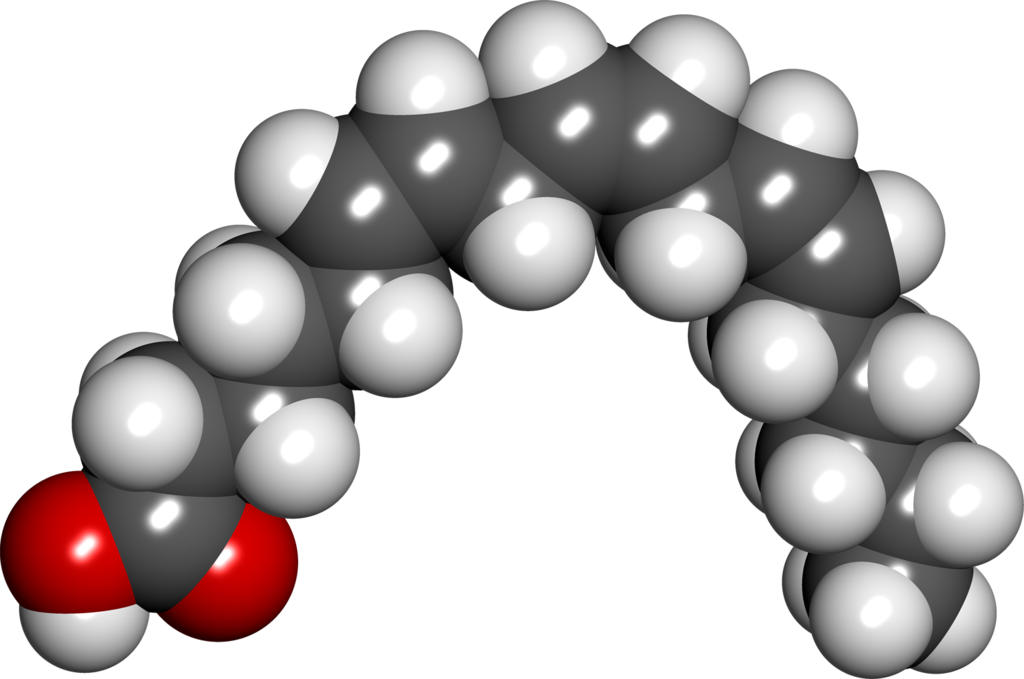 В составе мембранных фосфолипидов линолевая кислота функционирует как структурный компонент для поддержания определенного уровня мембранной текучести трансдермального водного барьера эпидермиса. Кроме того, при высвобождении из мембранных фосфолипидов она может быть ферментативно окислена до различных производных, участвующих в клеточной передаче сигналов (то есть 13-гидрокси или 13-гидропероксиоктадекадиеновой кислоты( 13-H (P) ODE).
В составе мембранных фосфолипидов линолевая кислота функционирует как структурный компонент для поддержания определенного уровня мембранной текучести трансдермального водного барьера эпидермиса. Кроме того, при высвобождении из мембранных фосфолипидов она может быть ферментативно окислена до различных производных, участвующих в клеточной передаче сигналов (то есть 13-гидрокси или 13-гидропероксиоктадекадиеновой кислоты( 13-H (P) ODE).
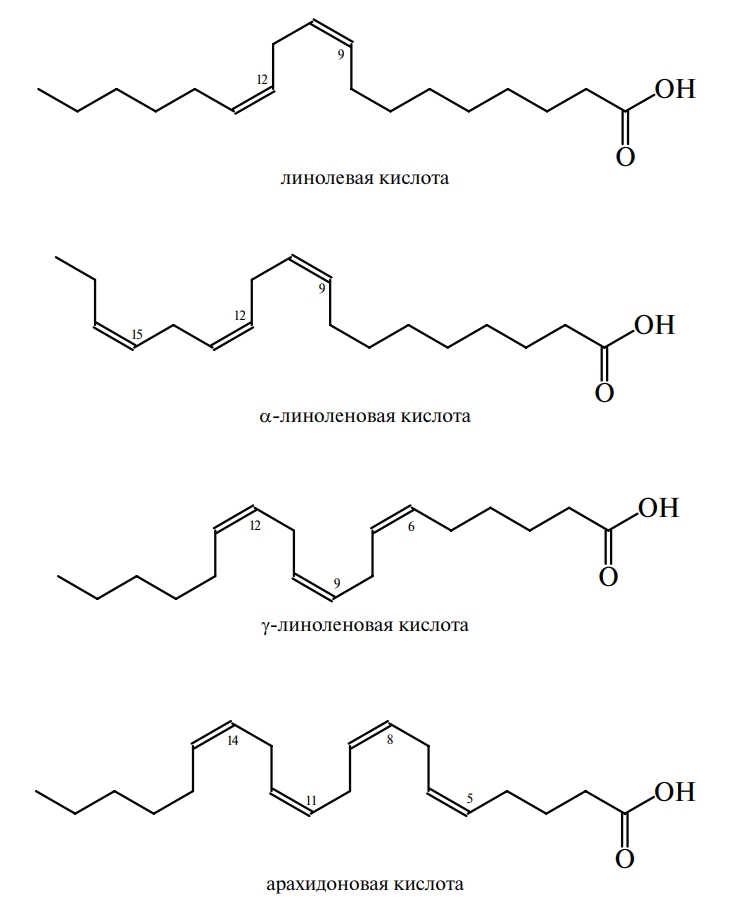
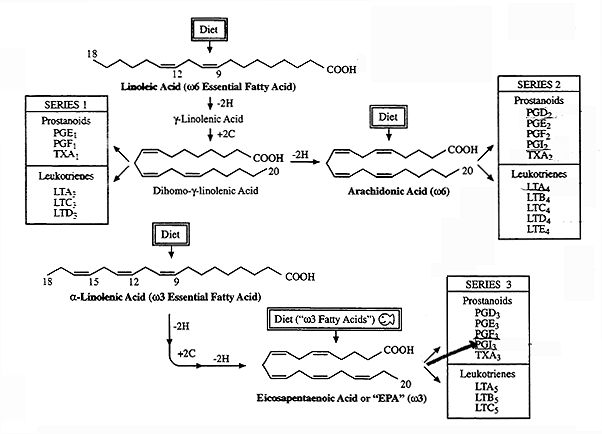
В качестве исходного соединения для семейства PU 6 PUFA линолевая кислота может быть удлиненной и ненасыщенной до других биоактивных СО 6 PUFA, таких как γ-линоленовая кислота (18: 3ω6) и арахидоновая кислота (20: 4ω6). Впоследствии арахидоновая кислота может быть превращена в мириады биологически активных соединений, называемых эйкозаноидами, такими как простагландины и лейкотриены. Эти эйкозаноиды важны при нормальной метаболической функции клеток и тканей, но при постоянном выделении и избытке они, как известно, способствуют ряду хронических заболеваний, таких как воспаление и онкология.
После потребления и абсорбции энтероцитами, выстилающими тонкий кищечник, линолевую кислоту упаковывают в хиломикроны в виде фосфолипидов, триацилглицеринов или эфиров холестерина и затем поступает в общую циркуляцию (подключичную вену) через грудной канал. Линолевая кислота доставляется в печеночные и внепеченочные ткани, так как хиломикроны делипидируются в пути и очищаются печенью при ее переходе на гораздо более мелкие остаточные частицы. После клеточного поглощения судьба линолевой кислоты определяется потребностями ткани, то есть включением в мембранные фосфолипиды, десатурацией и удлинением и т. Д.
Линолевая кислота является существенным (незаменимым) питательным веществом, которое содержит две двойные связи на девятом и 12-м атомах углерода из карбонильной функциональной группы. Поскольку люди не могут включать двойную связь за девятый углерод жирной кислоты, эта жирная кислота не может быть синтезирована и, следовательно, должна потребляться с пищей. В качестве основного компонента церамидов линолевая кислота участвует в поддержании трансдермального водного барьера эпидермиса. Содержание линолевой кислоты у младенцев может быть столь низким, как 0,5-2,0 % энергии, и лишение линолевой кислоты (то есть безжирное внутривенное вскармливание) может привести к чешуйчатым повреждениям кожи, замедлению роста и изменениям плазменной жирной кислоты и тромбоцитопении. Поскольку линолевая кислота находится в изобилии в детских смесях и продуктах питания и в грудном молоке человека, существенная нехватка жирных кислот не присуща здоровым людям. Аналогичным образом доказательство недостатка PU6 PUFA крайне редко встречается у взрослого населения в отсутствие врожденной ошибки метаболизма, то есть дефицита FADS2 (десатуразы жирных кислот 2, Δ6 десатуразы), скорости, ограничивающей скорость десатурации линолевых кислота к арахидоновой кислоте.
В качестве основного компонента церамидов линолевая кислота участвует в поддержании трансдермального водного барьера эпидермиса. Содержание линолевой кислоты у младенцев может быть столь низким, как 0,5-2,0 % энергии, и лишение линолевой кислоты (то есть безжирное внутривенное вскармливание) может привести к чешуйчатым повреждениям кожи, замедлению роста и изменениям плазменной жирной кислоты и тромбоцитопении. Поскольку линолевая кислота находится в изобилии в детских смесях и продуктах питания и в грудном молоке человека, существенная нехватка жирных кислот не присуща здоровым людям. Аналогичным образом доказательство недостатка PU6 PUFA крайне редко встречается у взрослого населения в отсутствие врожденной ошибки метаболизма, то есть дефицита FADS2 (десатуразы жирных кислот 2, Δ6 десатуразы), скорости, ограничивающей скорость десатурации линолевых кислота к арахидоновой кислоте.
Хотя линолевая кислота является важным питательным веществом, «нет никакой конкретной информации о количестве линолевой кислоты, необходимой для коррекции симптомов (ω6) дефицита ПНЖК», поэтому рекомендуемые ежедневные дозы(RDA) еще не установлены. Как таковые диетические эталонные дозы линолевой кислоты составляют адекватные дозы для женщин и мужчин в возрасте от 19 до 50 лет 12 г / сут и 17 г / сут соответственно. Данные основаны на приблизительном медианном потреблении здоровых людей.
Как таковые диетические эталонные дозы линолевой кислоты составляют адекватные дозы для женщин и мужчин в возрасте от 19 до 50 лет 12 г / сут и 17 г / сут соответственно. Данные основаны на приблизительном медианном потреблении здоровых людей.
Основными диетическими источниками линолевой кислоты являются растительные масла, орехи, семена, мясо и яйца. Потребление линолевой кислоты в рационе начало увеличиваться примерно в 1969 году и параллельно с введением соевого масла в качестве основной коммерческой добавки для многих обработанных пищевых продуктов. Производные продукты, содержащие соевое масло в качестве основного ингредиента, богаты линолевой кислотой. Хотя линолевая кислота составляет ~88% от общего количества ПНЖК в соевом масле, уровни в большинстве потребляемых пищевых продуктов превышают 70%. Например, из всех ПНЖК в большинстве видов мяса (говядина, курица и свинина) вклад линолевой кислоты составляет от 70 до 85% и> 80% в яйцах. Хотя хорошо известно, что большинство растительных масел основано на линолевой кислоте (отмеченное исключение — льняное семя), даже продукты с очень низким содержанием жира (овощи, фрукты и зерно) преимущественно богаты линолевой кислотой в качестве основной ПНЖК. Отмеченными исключениями являются бобы, в которых линолевая кислота составляет от 40 до 50% от общего количества ПНЖК.
Хотя хорошо известно, что большинство растительных масел основано на линолевой кислоте (отмеченное исключение — льняное семя), даже продукты с очень низким содержанием жира (овощи, фрукты и зерно) преимущественно богаты линолевой кислотой в качестве основной ПНЖК. Отмеченными исключениями являются бобы, в которых линолевая кислота составляет от 40 до 50% от общего количества ПНЖК.
Токсикологические данные:
Может быть токсичным при вдыхании, при контакте с кожей и при проглатывании.
При оральном применении (LD50): 3200 мг / кг [мышь].
При оральном применении (LD50): 3200 мг / кг [крыса].
Ненасыщенные кислоты и двойные C=C (углерод-углеродные) – связи
«Ненасыщенные кислоты и двойные C=C (углерод-углеродные) – связи» — статья из цикла: «Масло-восковая обработка древесины». В углеводородных цепях некоторых кислот (олеиновая, линолевая, линоленовая, элеостеариновая) между атомами углерода встречаются двойные связи. Двойная связь образуется, если простая σ-связь дополняется π-связью (более подробно об образовании одиночных и двойных ковалентных связей можно прочитать здесь).
Двойная связь образуется, если простая σ-связь дополняется π-связью (более подробно об образовании одиночных и двойных ковалентных связей можно прочитать здесь).
На схеме изображены атомы углерода, совместно использующие две пары электронов. В результате возникает двойная связь:
Двойная связь изображается двумя линиями:
На рисунке ниже представлена шаростержневая модель олеиновой кислоты C17h43COOH, входящая в состав льняного масла.
Структурная формула олеиновой кислоты: СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН.
Олеиновая кислота, как и стеариновая, содержит 17 атомов углерода и кислотную группу (–COOH) на конце (отсчёт идёт от углеродного атома, входящего в кислотную группу). Однако у неё имеется одна двойная связь между 9-м и 10-м атомами углерода. Эти атомы имеют по одной связи с соседними атомами углерода (с 8-м и 11-м), по одной связи с атомами водорода и двойную связь друг с другом.
Олеиновая кислота содержит 34 атома водорода против 36 в стеариновой кислоте. 9-й и 10-й атомы углерода удерживают только по одному атому водорода, потому что вторая пара электронов «пошла» на образование двойной связи. Про такие углеродные атомы говорят, что они не насыщены водородом. А саму кислоту относят к классу ненасыщенной (или непредельной). Ненасыщенные жирные кислоты содержат неполное количество атомов водорода, что означает наличие в них двойных связей.
9-й и 10-й атомы углерода удерживают только по одному атому водорода, потому что вторая пара электронов «пошла» на образование двойной связи. Про такие углеродные атомы говорят, что они не насыщены водородом. А саму кислоту относят к классу ненасыщенной (или непредельной). Ненасыщенные жирные кислоты содержат неполное количество атомов водорода, что означает наличие в них двойных связей.
Если молекула кислоты имеет только одну двойную связь, то она называется мононенасыщенной. При наличии двух и более двойных связей – полиненасыщенной.
На рисунках ниже представлены шаростержневые модели линолевой C17h41COOH и линоленовой C17h39COOH кислот, также входящих в состав льняного масла.
Структурная формула линолевой кислоты:
СН3 – (СН2)4 – СН = СН – Ch3 – CH = CH – (СН2)7 – СООН.
Структурная формула линоленовой кислоты:
СН3 – СН2 – СН = СН – Ch3 – CH = СН – Ch3 – CH = CH – (СН2)7 – СООН.
Линолевая и линоленовая кислоты относятся к группе жирных полиненасыщенных карбоновых кислот с двумя и тремя двойными связями соответственно.
Если внимательно посмотреть на строение этих кислот, то мы увидим, что углеводородная цепь в месте двойных связей как бы «перегибается» (меняется валентный угол). В этом месте молекула оказывается зафиксированной и её вращательная изомеризация между конформерами, различающимися конфигурацией относительно двойной связи, невозможна.
Этот «перегиб» обеспечивает существование ненасыщенных жирных кислот в виде геометрических изомеров, которые носят название «цис-конформаций». Все кислоты, которые встречаются в природе существуют в «цис-конфигурации» и, крайне редко, в «транс-конфигурации» (вследствие поворота вокруг двойной связи, как у элеостеариновой кислоты).
«Цис-конфигурация» кислоты придаёт углеводородной цепи изогнутый и укороченный вид. Такое строение не позволяет молекулам находиться близко друг к другу, уменьшает силы их взаимного притяжения, по этой причине они занимают больший объём, а при образовании кристаллов упаковываются не так плотно, как «транс-изомеры». Вследствие этого «цис-изомеры» кислот образуют менее прочные кристаллы, чем «транс-изомеры» и, соответственно, имеют более низкую температуру плавления/застывания. Масла, большую часть которых составляют полиненасыщенные (непредельные) жирные кислоты, при комнатной температуре остаются жидкими.
Вследствие этого «цис-изомеры» кислот образуют менее прочные кристаллы, чем «транс-изомеры» и, соответственно, имеют более низкую температуру плавления/застывания. Масла, большую часть которых составляют полиненасыщенные (непредельные) жирные кислоты, при комнатной температуре остаются жидкими.
Порядок (одиночная или двойная) связи сильно влияет на её свойства. Чем больше порядок, тем меньше длина и выше энергия химической связи. Двойные связи химически очень активны.
Атом углерода «чувствует» себя лучше всего тогда, когда все его четыре связи «торчат» в разные стороны. Если же две из них вынуждены расположиться между соседними атомами углерода, то в молекуле возникает некоторое напряжение.
Двойная связь — это нечто вроде уязвимого места углеродной цепи, она активнее простой. Другие химические вещества «атакуют» молекулу обычно именно в этом месте. Если такая атака оказывается достаточно энергичной, двойная связь может быть совсем разорванной, и цепочка распадётся. В результате могут быть получены другие вещества с совершенно иными свойствами.
В результате могут быть получены другие вещества с совершенно иными свойствами.
При высыхании масла на открытом воздухе (процесс самоокисления) «атака» осуществляется атомами кислорода. Атомарный кислород играет роль строительного материала – образует мостики (связи), другими словами, «сшивает» молекулы соседних кислот по месту двойных связей, приводя к постепенному образованию полимерных продуктов.
Происходит нечто вроде полимеризации: масло превращается в скопление связанных между собой гигантских молекул и образует прочную твёрдую плёнку сетчатой пространственной структуры. Она не плавится и не растворяется в органических растворителях. Реакция полимеризации необратима (подробно процессы полимеризации рассмотрены в главе «Теоретические основы плёнкообразования масел» — раздел находится в работе).
Следует отметить, что на скорость высыхания масла влияет не только количество двойных связей, но и их положение в углеводородной цепи. Различают изолированные и сопряжённые (конъюгированные) связи. Изолированные двойные связи отделены друг от друга метиленовой группой (–Ch3–). Сопряжённые – разделяются одиночной связью.
Изолированные двойные связи отделены друг от друга метиленовой группой (–Ch3–). Сопряжённые – разделяются одиночной связью.
Например, изолированные двойные связи содержатся в молекулах линолевой и линоленовой кислот (группа льняного масла). Сопряжённые – в молекулах элеостеариновой кислоты (группа тунгового масла).
Структурная формула элеостеариновой кислоты:
СН3 – (СН2)3 – СН = СН – CH = СН – CH = CH – (СН2)7 – СООН.
Примечание. На рисунке выше изображён изомер альфа-элеостеариновой кислоты, преимущественно содержащийся в тунговом масле. Для сокращения записи я буду называть его просто элеостеариновой кислотой.
У элеостеариновой кислоты участки с двойной связью между 11-м и 12-м, 13-м и 14-м атомами углерода находятся в транс-конфигурации, в то время, как двойная связь между 9-м и 10-м атомами углерода – в цис-конфигурации: углеводородная цепь молекулы в этом месте перегибается. Поэтому можно сказать, что элеостеариновая кислота находится в цис-транс-транс-конфигурации.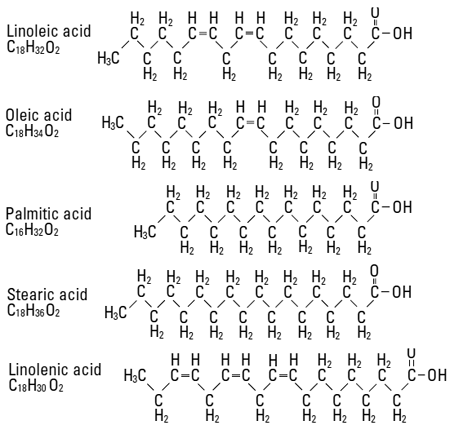
Для кислот, содержащих несколько метиленразделённых двойных связей (линолевая и линоленовая кислоты имеют метиленовые группы (–Ch3–) между двойными связями), угол изгиба цепи возрастает с увеличением количества двойных связей, что, как я уже отмечал, приводит к уменьшению длины и увеличению площади поперечного сечения молекулы. Это обстоятельство препятствует более плотной упаковке молекул в кристаллах и снижению температуры плавления и застывания.
Температура плавления/застывания ненасыщенных кислот с метиленразделёнными (изолированными) двойными связями (транс-конфигурации) всегда ниже, чем насыщенных (цис-конфигурации). А у ненасыщенных кислот с сопряжёнными двойными связями (цис-транс-конфигурации) температура плавления/застывания всегда выше, чем у ненасыщенных с изолированными связями. Это обусловлено меньшим изгибом их молекул и более плотной их упаковкой. Элеостеариновая кислота при комнатной температуре представляет собой твёрдое вещество, а тунговое масло — малоподвижную гелеообразную жидкость.
Итак, масла, которые содержат кислоты с сопряжёнными двойными связями высыхают быстрее, чем с изолированными. Скорость высыхания масла зависит от количества и положения двойных связей в молекулах кислот, входящих в его состав. Чем выше доля таких кислот и, соответственно, больше двойных сопряжённых связей, тем быстрее идёт образование продуктов полимеризации масла.
Содержание работы…
Линолевая кислота — Тосканская диета
Линолевая кислота или LA или 18:2n-6 относится к группе липидов, известных как ненасыщенные жирные кислоты. Он имеет 18 атомов углерода и две двойные связи цис в положениях 9 и 12. Поскольку первая двойная связь по отношению к метильному концу расположена в положении 6, это полиненасыщенная жирная кислота омега-6 (ПНЖК) или омега-6 жирная кислота.
Линолевая кислота, от латинского linon , что означает лен, плюс олеиновая, что означает масло, была выделена Сакком Ф. в 1844 году из льняного масла, структура была уточнена Hilditch T. P. и другие. в 1939, и был синтезирован Рафаэлем Р.А. и Sondheimer F. в 1950 году.
P. и другие. в 1939, и был синтезирован Рафаэлем Р.А. и Sondheimer F. в 1950 году.
Линолевая кислота
Многие животные, включая человека, не могут ее синтезировать. Для этих животных линолевая кислота и альфа-линоленовая кислота или АЛК, которая является предшественником омега-3 полиненасыщенных жирных кислот или омега-3 жирных кислот, являются незаменимыми жирными кислотами, то есть жирными кислотами, которые необходимо получать из рациона. Кроме того, в отсутствие диетической LA другие омега-6 ПНЖК гамма-линоленовая кислота, дигомо-гамма-линоленовая кислота, арахидоновая кислота или ARA и адренокислота также становятся незаменимыми, поскольку она является их предшественником. По этой причине они определены как условно незаменимые жирные кислоты.
Как и другие жирные кислоты, редко встречается в свободной форме; чаще всего он связан сложноэфирными связями с органическими молекулами, такими как стеролы, глицерин и глицерол-3-фосфат, с образованием более сложных липидов, таких как сложные эфиры стеролов, например эфиры холестерина, триглицериды и фосфолипиды.
У людей он в изобилии содержится в жировой ткани и липопротеинах плазмы.
Он выполняет множество функций как прямо, так и косвенно через свои метаболиты. Его можно использовать для получения энергии. Это структурный компонент клеточных мембран. Он участвует в поддержании трансэпидермального водного барьера. Он служит предшественником для синтеза полиненасыщенных жирных кислот омега-6. Он может денасыщаться до альфа-линоленовой кислоты в сосудистых наземных растениях и фитопланктоне. Подобно ARA и докозагексаеновой кислоте или DHA, жирной кислоте омега-3, линолевая кислота служит предшественником для синтеза биоактивных липидных медиаторов. Наконец, было показано, что потребление LA с пищей обратно пропорционально риску ишемической болезни сердца.
Это самая распространенная ПНЖК в западной диете и единственная, потребление которой значительно увеличилось, в то время как потребление других жирных кислот омега-6 и омега-3 оставалось относительно постоянным с начала 1900-х годов, что соответствует меньшему менее 1% от суточной калорийности.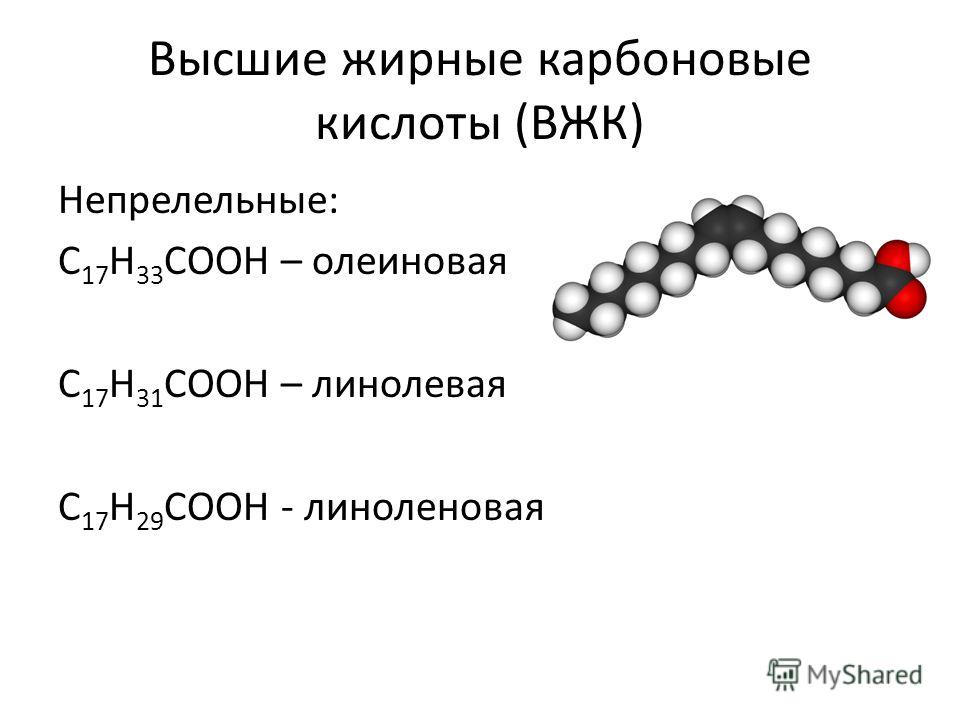 Высокое потребление LA изменило соотношение омега-6 к омега-3 с 4:1 до 20:1.
Высокое потребление LA изменило соотношение омега-6 к омега-3 с 4:1 до 20:1.
Дефицит линолевой кислоты приводит к задержке роста и заживлению ран, дерматиту, репродуктивным проблемам, ожирению печени и полидипсии. Однако его дефицит встречается крайне редко из-за его обилия в западной диете и, следовательно, в грудном молоке, а также из-за его присутствия в детских смесях.
Основными пищевыми источниками являются соевое, кукурузное, подсолнечное, рапсовое и сафлоровое масла.
СВОЙСТВА, НАЗВАНИЯ И ИДЕНТИФИКАТОРЫ
Молекулярная масса: 280,447 г/моль
Молекулярная формула: C 18 H 32 O 2
точка: 230 °C (446 °F, 503,15 K) при 16 мм рт. Номер Европейского сообщества (ЕС): 200-470-9
В очищенном виде представляет собой бесцветное масло.
СОДЕРЖАНИЕ
- Синтез линолевой кислоты
- Распределение линолевой кислоты
- Метаболиты линолевой кислоты
- Роль линолевой кислоты
- Источники пищи
- Новые сорта
- Ссылки
Синтез линолевой кислоты
Линолевая кислота синтезируется из олеиновой кислоты, ненасыщенной жирной кислоты с цепью из 18 атомов углерода и двойной связью цис- в положении 9по отношению к метильному концу, поэтому омега-9 жирная кислота.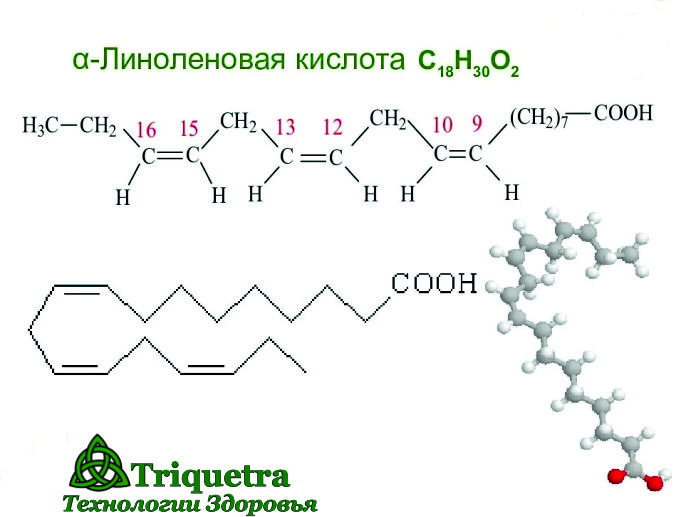
Реакция, катализируемая дельта-12-десатуразой (EC 1.14.19.6), вводит вторую цис- двойную связь между атомами углерода 12 и 13 и является критическим этапом биосинтеза ПНЖК омега-6. .
Синтез и метаболизм линолевой кислоты
Следует подчеркнуть, что дельта-12-десатураза катализирует переход от омега-9 жирных кислот к омега-6 жирным кислотам.
Долгое время считалось, что этот фермент присутствует только в бактериях, простейших и растениях и что только эти организмы способны синтезировать линолевую кислоту. Однако в 1961 было показано, что насекомое, американский таракан Periplaneta americana , способно синтезировать линолевую кислоту. Впоследствии синтез МА был обнаружен у других насекомых и других беспозвоночных, в том числе у некоторых нематод, ракообразных и клещей.
Распределение линолевой кислоты
Линолевая кислота вместе с пальмитиновой и олеиновой кислотами является одной из наиболее распространенных жирных кислот в триглицеридах жировой ткани и липопротеинах плазмы, где ее концентрация отражает потребление с пищей.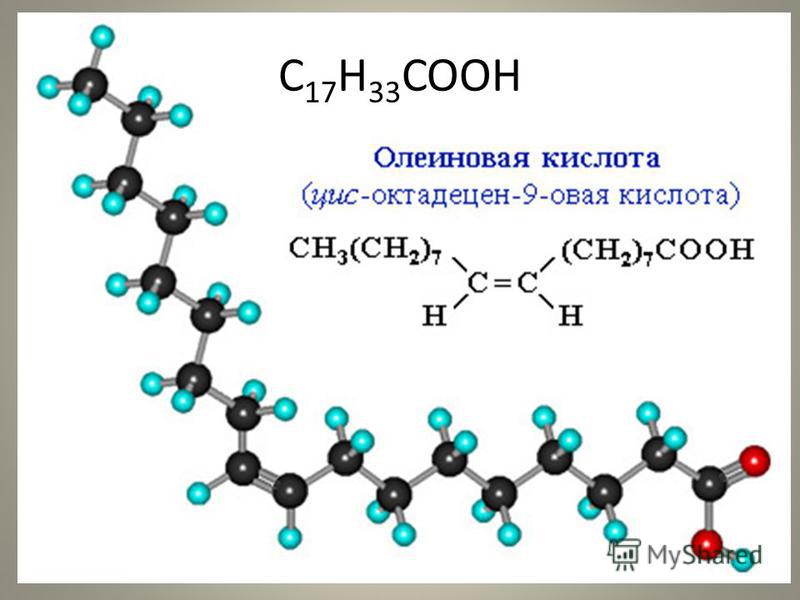 В США значительное увеличение потребления LA с пищей сопровождалось увеличением ее содержания в жировой ткани, которое оценивается >130%. Из-за своего обилия и подверженности окислению линолевая кислота является жирной кислотой, которая чаще всего окисляется в ЛПНП. А окисление липидов ЛПНП является фактором риска ишемической болезни сердца.
В США значительное увеличение потребления LA с пищей сопровождалось увеличением ее содержания в жировой ткани, которое оценивается >130%. Из-за своего обилия и подверженности окислению линолевая кислота является жирной кислотой, которая чаще всего окисляется в ЛПНП. А окисление липидов ЛПНП является фактором риска ишемической болезни сердца.
Хотя он необходим для развития нервной системы плода, он присутствует в мозге в низких концентрациях, менее 2% от общего количества жирных кислот, что намного ниже, чем у пальмитиновой кислоты, стеариновой кислоты, олеиновой кислоты, ДГК и АРК, на долю которых приходится более 84% мозгового вещества. жирные кислоты.
Это самая распространенная ПНЖК в эпидермисе.
Метаболиты линолевой кислоты
Линолевая кислота является предшественником всех омега-6 жирных кислот.
Его можно десатурировать до альфа-линоленовой кислоты, предшественника омега-3 ПНЖК. Реакцию катализирует дельта-15-десатураза (КФ 1.14.19.25), который присутствует только в пластидах и в эндоплазматическом ретикулуме фитопланктона и сосудистых наземных растений. Следует подчеркнуть, что дельта-15-десатураза катализирует переход от омега-6 жирных кислот к омега-3 жирным кислотам.
Следует подчеркнуть, что дельта-15-десатураза катализирует переход от омега-6 жирных кислот к омега-3 жирным кислотам.
Является предшественником биоактивных липидных медиаторов с аутокринным и паракринным действием, которые участвуют в регуляции многих клеточных процессов. Подобно арахидоновой и докозагексаеновой кислотам, при высвобождении из фосфолипидов мембраны она может окисляться в реакциях, катализируемых такими ферментами, как 12-липоксигеназа (КФ 1.13.11.31), 15-липоксигеназа (КФ 1.13.11.33), циклооксигеназы (КФ 1.14. 99.1), растворимой эпоксигидролазой (КФ 3.3.2.10) и ферментами семейства цитохромов Р450, а именно теми же ферментами, которые участвуют в метаболизме АРК и ДГК. Он также может быть окислен свободными радикалами. Продуцируемые медиаторы, такие как эпокси- и моно-, ди- и тригидроксипроизводные, называемые метаболитами окисленной линолевой кислоты (OXLAM), участвуют в передаче клеточных сигналов и регуляции боли и воспаления.
Поскольку линолевая кислота может быть преобразована в арахидоновую кислоту, которая является предшественником биоактивных липидных медиаторов, некоторые из которых обладают противовоспалительной активностью или способны способствовать разрешению воспалительных повреждений, другие обладают провоспалительной активностью, было высказано предположение, что уровни ARA можно уменьшить, уменьшив потребление LA. Однако, по крайней мере, у субъектов, придерживающихся типичной западной диеты, этого, по-видимому, не происходит, поскольку преобразование LA в ARA очень скромное, от 0,3% до 0,6%, аналогично тому, что происходит при преобразовании ALA в DHA. Кроме того, было высказано предположение, что на профиль липидных медиаторов, а также на воспалительную реакцию на диету, богатую линолевой кислотой, влияют генотип FADS1 , где ген FADS1 кодирует дельта-5-десатуразу (КФ 1.14.19.44), фермент, катализирующий вторую реакцию десатурации пути синтеза арахидоновой кислоты, то есть десатурацию дигомо-гамма-линоленовой кислоты до АРА.
Однако, по крайней мере, у субъектов, придерживающихся типичной западной диеты, этого, по-видимому, не происходит, поскольку преобразование LA в ARA очень скромное, от 0,3% до 0,6%, аналогично тому, что происходит при преобразовании ALA в DHA. Кроме того, было высказано предположение, что на профиль липидных медиаторов, а также на воспалительную реакцию на диету, богатую линолевой кислотой, влияют генотип FADS1 , где ген FADS1 кодирует дельта-5-десатуразу (КФ 1.14.19.44), фермент, катализирующий вторую реакцию десатурации пути синтеза арахидоновой кислоты, то есть десатурацию дигомо-гамма-линоленовой кислоты до АРА.
Роль линолевой кислоты
Для большинства животных, включая человека, линолевая кислота является незаменимой жирной кислотой и играет важную роль, действуя напрямую или через свои метаболиты.
- Может использоваться как источник энергии. Например, он поступает в мозг со скоростью, сравнимой со скоростью ДГК, АРК и других жирных кислот.
 ARA и DHA в основном входят в состав мембранных фосфолипидов, тогда как почти 60% линолевой кислоты окисляется по пути бета-окисления. Кроме того, часть произведенного ацетата используется для синтеза холестерина в головном мозге.
ARA и DHA в основном входят в состав мембранных фосфолипидов, тогда как почти 60% линолевой кислоты окисляется по пути бета-окисления. Кроме того, часть произведенного ацетата используется для синтеза холестерина в головном мозге. - В качестве компонента мембранных фосфолипидов он участвует в поддержании текучести мембран.
- В составе мембранных сфинголипидов участвует в формировании и поддержании водопроницаемого барьера кожи.
- Он может связываться с PPARα и активировать его.
Этот фактор транскрипции играет важную роль в регуляции метаболизма. Например, он ингибирует транскрипцию генов, кодирующих ферменты, участвующие в липогенезе, и активирует транскрипцию генов, кодирующих ферменты, участвующие в липолизе, а также в митохондриальном и лизосомальном бета-окислении. Таким образом, линолевая кислота может снижать уровень общего холестерина и холестерина ЛПНП в плазме, тем самым способствуя снижению сердечно-сосудистого риска.
Источники пищи
В двадцатом веке потребление растительных масел, богатых линолевой кислотой, в Соединенных Штатах увеличилось в 20 раз.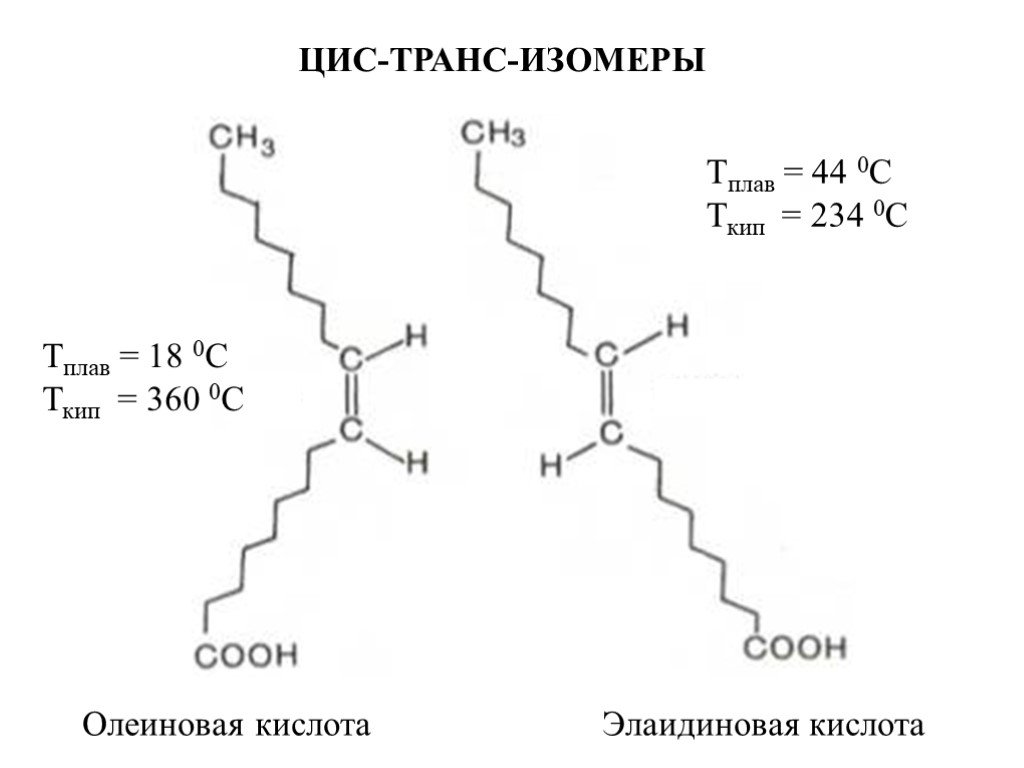 Это увеличение произошло из-за:
Это увеличение произошло из-за:
- разработки сортов, дающих семена с высоким содержанием LA, особенно сои и кукурузы;
- повышенная коммерческая доступность производных масел;
- диетических рекомендаций по увеличению его потребления в качестве средства для снижения уровня холестерина в крови, рекомендации, полученные в результате исследований американского физиолога Анселя Киза в середине 19-го века.50-е годы.
Это привело к нынешнему уровню потребления LA, составляющему около 6% от общей калорийности рациона, по сравнению со значениями до 1930-х годов, которые варьировались от 1 до 2% от общей калорийности рациона.
В диете США соевое масло является основным диетическим источником LA, на долю которого приходится около 45% его пищевого потребления.
Другими продуктами, богатыми линолевой кислотой, являются кислое кукурузное, подсолнечное, сафлоровое и рапсовое масла и соответствующие семена, а также грецкие орехи, арахис, семена хлопка и кунжута.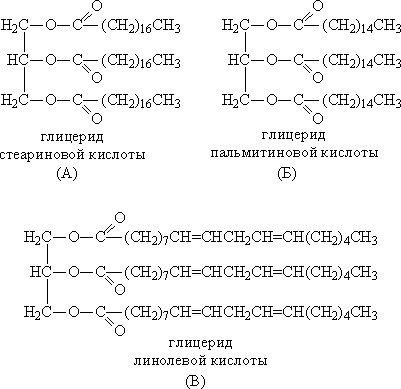
Животные, получающие пищу, богатую линолевой кислотой, также могут быть хорошим источником.
Это самая распространенная ПНЖК в пищевых продуктах. Самые высокие значения снова обнаружены в соевом масле, где оно составляет до 88% от общего количества ПНЖК и превышает 70% от общего количества ПНЖК в наиболее часто потребляемых продуктах питания. Например, в свинине, говядине и курятине она составляет от 75 до 85% от общего количества ПНЖК, а в яйцах превышает 80%. Более того, это основная ПНЖК в овощах, фруктах и злаках, то есть в продуктах с низким содержанием жира. Исключение составляет фасоль, где на ее долю приходится 40-50% от общего количества ПНЖК.
Новые сорта
В природе линолевая кислота синтезируется в концентрациях, сравнимых с концентрациями альфа-линоленовой кислоты.
Хотя в 1930-х годах были отобраны сорта, дающие семена с высоким содержанием LA, в последние годы эта тенденция меняется, поскольку были выбраны новые сорта, дающие семена с более низким содержанием LA.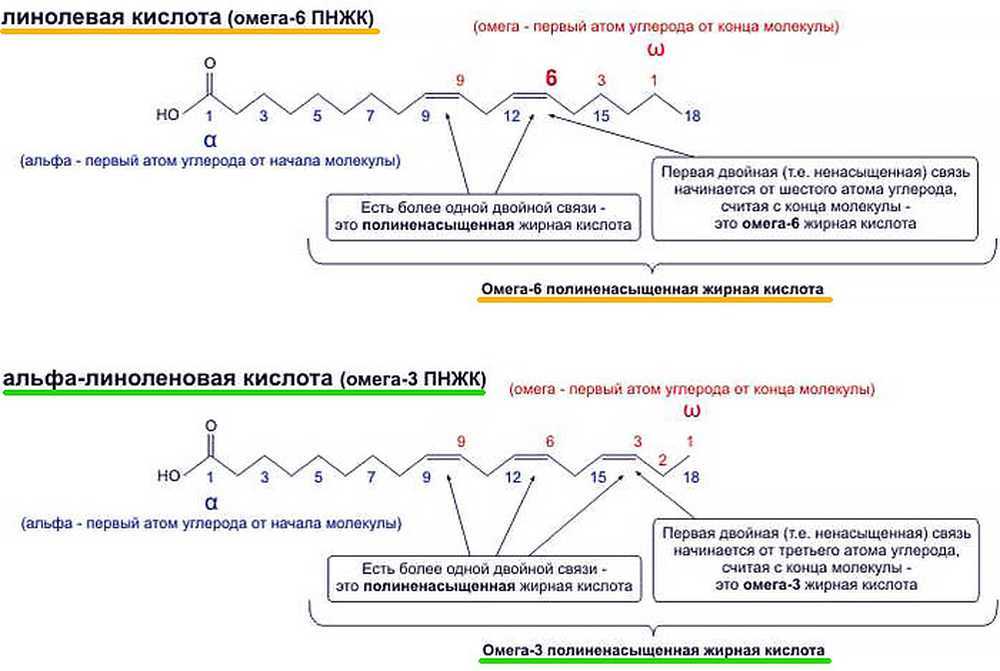 Более того, по большей части линолевая кислота заменена олеиновой кислотой. Это позволило получить не только подсолнечное и сафлоровое масла с высоким содержанием олеиновой кислоты вместо высокого содержания МК, но и соевые бобы с высоким содержанием олеиновой кислоты. И поскольку новые сорта заменят традиционные сорта, предположительно произойдет сокращение потребления линолевой кислоты в пользу олеиновой. Это может привести к тому, что уровни потребления МА вернутся к уровням, сопоставимым с теми, что были в начале 19 века.00с. Этот переход может принести пользу для здоровья, поскольку потребление олеиновой кислоты связано с улучшением уровня холестерина ЛПВП. Следует подчеркнуть, что хорошее потребление олеиновой кислоты с пищей в виде оливкового масла первого холодного отжима является особенностью средиземноморской диеты.
Более того, по большей части линолевая кислота заменена олеиновой кислотой. Это позволило получить не только подсолнечное и сафлоровое масла с высоким содержанием олеиновой кислоты вместо высокого содержания МК, но и соевые бобы с высоким содержанием олеиновой кислоты. И поскольку новые сорта заменят традиционные сорта, предположительно произойдет сокращение потребления линолевой кислоты в пользу олеиновой. Это может привести к тому, что уровни потребления МА вернутся к уровням, сопоставимым с теми, что были в начале 19 века.00с. Этот переход может принести пользу для здоровья, поскольку потребление олеиновой кислоты связано с улучшением уровня холестерина ЛПВП. Следует подчеркнуть, что хорошее потребление олеиновой кислоты с пищей в виде оливкового масла первого холодного отжима является особенностью средиземноморской диеты.
Каталожные номера
- Akoh C.C. и Мин Д.Б. Пищевые липиды: химия, питание и биотехнология. 3-е издание. CRC Press, Taylor & Фрэнсис Групп, 2008
- Blasbalg T.
 L., Hibbeln J.R., Ramsden C.E., Majchrzak S.F. & Rawlings R.R. Изменения в потреблении омега-3 и омега-6 жирных кислот в Соединенных Штатах в течение 20-го века. Ам Дж. Клин Нутр 2011; 93(5):950-962. doi:10.3945/ajcn.110.006643
L., Hibbeln J.R., Ramsden C.E., Majchrzak S.F. & Rawlings R.R. Изменения в потреблении омега-3 и омега-6 жирных кислот в Соединенных Штатах в течение 20-го века. Ам Дж. Клин Нутр 2011; 93(5):950-962. doi:10.3945/ajcn.110.006643 - Чоу Чинг К. Жирные кислоты в пищевых продуктах и их значение для здоровья. 3-е издание. CRC Press, Taylor & Фрэнсис Групп, 2008
- Фарвид М.С., Дин М., Пан А., Сунь К., Чиуве С.Е., Штеффен Л.М., Уиллетт В.К., Ху Ф.Б. Пищевая линолевая кислота и риск ишемической болезни сердца: систематический обзор и метаанализ проспективных когортных исследований. Тираж 2014; 130:1568-1578. doi:10.1161/РАСПИСАНИЕAHA.114.010236
- Гиене С.Дж., Карлсон С.Е. Увеличение содержания линолевой кислоты в жировой ткани взрослых людей США за последние полвека. Adv Nutr 2015;6(6):660-664. дои: https://DOI.org/10.3945/ан.115.009944
- Яндачек Р.Дж. Линолевая кислота: проблемы с питанием. Здравоохранение 2017;5(2):25. doi:10.3390/здравоохранение5020025
- Lankinen M.
 A., Fauland A., Shimizu B., Agren J., Wheelock CE, Laakso M., Schwab U. и Pihlajamaki J. Воспалительная реакция на пищевую линолевую кислоту зависит от генотипа FADS1 . Ам Дж. Клин Нутр 2019; 109: 165–175. дои: 10.1093/ajcn/nqy287
A., Fauland A., Shimizu B., Agren J., Wheelock CE, Laakso M., Schwab U. и Pihlajamaki J. Воспалительная реакция на пищевую линолевую кислоту зависит от генотипа FADS1 . Ам Дж. Клин Нутр 2019; 109: 165–175. дои: 10.1093/ajcn/nqy287 - Мальцицка М., Виссер Б., Эллерс Дж. Эволюционный взгляд на синтез линолевой кислоты у животных. Эвол Биол 2018;45:15-26. дои: 10.1007/s11692-017-9436-5
- Шустер С. Джонсон С.Д., Хеннебель М., Холтманн Т., Таха А.Ю., Кирпич И.А., Эгучи А., Рамсден С.Е., Папучадо Б.Г., Макклейн С.Дж., Фельдштейн А.Е. Окисленные метаболиты линолевой кислоты вызывают дисфункцию митохондрий печени, апоптоз и активацию NLRP3 в мышей. J Lipid Res 2018;59(9):1597-1609. дои: 10.1194/jlr.M083741
- Таха А.Ю. Линолевая кислота — полезная или вредная для мозга? NPJ Sci Food 2020; 4:1. дои: 10.1038/s41538-019-0061-9
- Уилан Дж. и Фриче К. Линолевая кислота. Ад Нутр 2013;4(3): 311-312. Дои: 10.3945/ан.113.003772
Explorer — Линолевая кислота (LA; цис-18:2n-6) (Соединение)
Перейти к классификации соединений
Химические данные
Данные MolDBi
| Название IUPAC 2 2 2 -9,12-dienoic acid | |
|---|---|
| Traditional IUPAC Name | linoleic |
| Formula | C18h42O2 |
| InChI | InChI=1S/C18h42O2/c1-2-3-4-5-6- 7-8-9-10-11-12-13-14-15-16-17-18(19)20/h6-7,9-10H,2-5,8,11-17h3,1h4,(H,19,20)/b7-6-,10-9- |
| ИнЧИ Ключ | OYHQOLUKZRVURQ- HZJYTTRNSA-N |
| Molecular weight | 280. 4455 4455 |
| Exact mass | 280.240230268 |
| SMILES | CCCCC\C=C/C\C=C/CCCCCCCC(O)=O |
ClassyFire Таксономия
| Описание | принадлежит к классу органических соединений, известных как линеоловые кислоты и их производные. Это производные линеоловой кислоты. Линеоловая кислота представляет собой полиненасыщенную жирную кислоту омега-6, состоящую из 18 атомов углерода, с двумя двойными СС-связями в положении 9 атомов углерода.- и 12-поз. |
|---|---|
| Kingdom | Organic compounds |
| Super Class | Lipids and lipid-like molecules |
| Class | Fatty Acyls |
| Sub Class | Lineolic acids and derivatives |
| Direct Parent | Линеоловые кислоты и производные |
| Альтернативные родительские компоненты |
|
Publications with Linoleic acid (LA; cis-18:2n-6)
Данные биомаркеров
Measurements of Linoleic acid (LA; cis-18:2n-6) in biospecimens
Concentration values
| ID | Parent ID | Depth | Subject group | Population | Country | Cohort | Определение времени биомаркера | Биообразец | Аналитический метод | Биомаркер | Детали биомаркера | Размер измерения | Обнаружено (nb) | Обнаружено (%) | Только обнаружено? | Arithmethic mean | Arithmethic SD | Geometric mean | Geometric SD | Min | Min (detected) | Percentile_05 | Percentile_10 | Percentile_25 | Median | Percentile_75 | Percentile_90 | Percentile_95 | Max | Межквартильный диапазон | Среднее 95% ДИ нижнее | Среднее 95% ДИ верхнее | GMсреднее 95% ДИ нижнее | GMean 95% CI upper | Unit | Converted arithmetic mean | Converted geometric mean | Converted median | Converted unit | Adjustment type | Adjusted on | Regressed on | Expressed as | Publication |
|---|
Значения воспроизводимости
Associations of Linoleic acid (LA; cis-18:2n-6) with exposures
Correlation values
| ID | Intake ID | Excretion ID | Subject group | Население | Страна | Когорта | Определение времени приема | Метод оценки приема | Прием | Детали приема | Включен ли дополнительный прием? | Intake Arithmetic mean | Intake Geometric mean | Intake Median | Intake Unit | Intake Adjusted on | Biomarker Time definition | Biospecimen | Analytical method | Biomarker | Biomarker detail | Biomarker Arithmetic mean | Biomarker Среднее геометрическое | Медиана биомаркера | Единица биомаркера | Биомаркер с поправкой на | Размер корреляции | Тип корреляции | Значение корреляции | Корреляция 95% ДИ нижний | Корреляция 95% ДИ верхний | Значение p корреляции | Значимый? | Регулировка измерения | Снижено затухание? | Ковариаты | Публикация |
|---|
Метаболомические ассоциации
Microbiota associations
| ID | Biomarker | Experimental evidence | Organism | Biospecimen | Antibiotic | Bacterial source | Substrate | Publication |
|---|
 ARA и DHA в основном входят в состав мембранных фосфолипидов, тогда как почти 60% линолевой кислоты окисляется по пути бета-окисления. Кроме того, часть произведенного ацетата используется для синтеза холестерина в головном мозге.
ARA и DHA в основном входят в состав мембранных фосфолипидов, тогда как почти 60% линолевой кислоты окисляется по пути бета-окисления. Кроме того, часть произведенного ацетата используется для синтеза холестерина в головном мозге. L., Hibbeln J.R., Ramsden C.E., Majchrzak S.F. & Rawlings R.R. Изменения в потреблении омега-3 и омега-6 жирных кислот в Соединенных Штатах в течение 20-го века. Ам Дж. Клин Нутр 2011; 93(5):950-962. doi:10.3945/ajcn.110.006643
L., Hibbeln J.R., Ramsden C.E., Majchrzak S.F. & Rawlings R.R. Изменения в потреблении омега-3 и омега-6 жирных кислот в Соединенных Штатах в течение 20-го века. Ам Дж. Клин Нутр 2011; 93(5):950-962. doi:10.3945/ajcn.110.006643 A., Fauland A., Shimizu B., Agren J., Wheelock CE, Laakso M., Schwab U. и Pihlajamaki J. Воспалительная реакция на пищевую линолевую кислоту зависит от генотипа FADS1 . Ам Дж. Клин Нутр 2019; 109: 165–175. дои: 10.1093/ajcn/nqy287
A., Fauland A., Shimizu B., Agren J., Wheelock CE, Laakso M., Schwab U. и Pihlajamaki J. Воспалительная реакция на пищевую линолевую кислоту зависит от генотипа FADS1 . Ам Дж. Клин Нутр 2019; 109: 165–175. дои: 10.1093/ajcn/nqy287